9月12日,美国《科学》杂志-美国科学促进会(Science-AAAS)在中国科学院上海药物研究所召开新闻发布会,介绍中科院上海药物研究所吴蓓丽研究员研究组在趋化因子受体CCR5结构生物学领域取得重大突破性进展。这也是《科学》杂志-美国科学促进会第一次在上海召开新闻发布会。
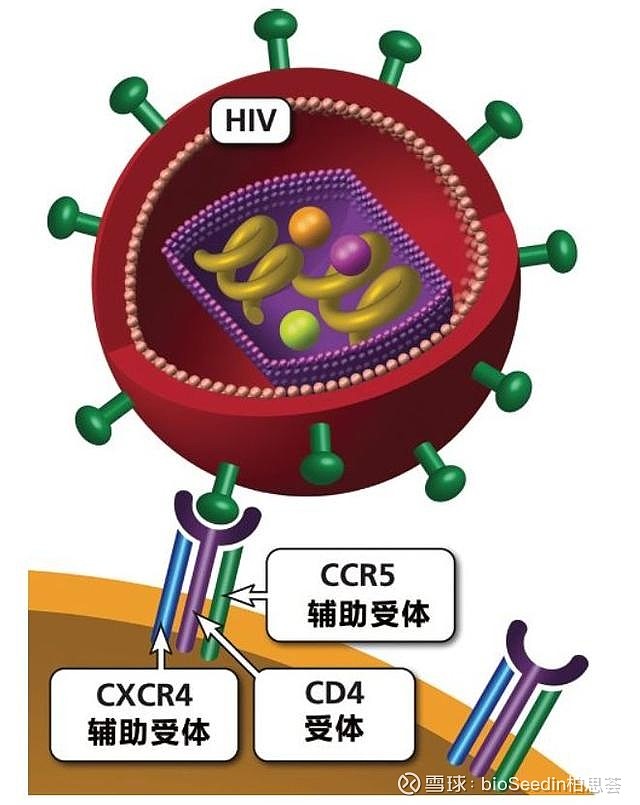
CCR5是一种位于细胞表面的受体蛋白质,作为艾滋病毒共受体之一,在大多数种类艾滋病毒感染人体免疫细胞时发挥重要作用。然而,其三维结构的解析极具挑战性,长久以来一直困扰着国内外科学家。日前,由中国科学院上海药物研究所和美国Scripps研究所的科学家组成的研究团队终于在该项研究中取得了突破性研究成果,成功解析了CCR5蛋白质分子的高分辨率三维结构,并据此揭示了抗艾滋病毒感染的药物马拉维若是如何作用于该受体分子进而阻断病毒入侵的分子机制。
“这些结构信息将帮助我们更加准确地理解艾滋病毒感染细胞的机制,并有助于研发出更为有效的抗艾滋病毒感染的新型药物,”中国科学院上海药物研究所的吴蓓丽研究员说。吴蓓丽研究员是该项研究的负责人,相关研究成果于9月12日发表在国际权威杂志《科学》(Science)上,上海药物所为第一单位。
这项针对艾滋病毒共受体CCR5的研究获得了来自中美两国的科研经费支持,“解决重大科学难题需要更多类似的国际合作,”该研究的主要合作者之一——美国加州Scripps研究所的Raymond C.Stevens教授说,“目前我们已经解析了两种艾滋病毒共受体CXCR4和CCR5的三维结构,抗艾滋病毒感染新方法的研究也将有望取得突破。”
一种重要的药物靶点
CCR5受体是新型抗艾滋病毒药物研发中最受关注的靶点之一。最初,人们认为艾滋病毒仅通过受体CD4的作用即可感染人体细胞艾滋病初期,直到1996年,科学家才发现艾滋病毒感染还需要共受体(通常是CCR5)的共同作用。研究人员发现某些特定的CCR5突变体能够显著地提高或降低人体被艾滋病毒感染的几率以及被感染后病情发展的速度,例如,研究发现约百分之十的欧洲人体内具有一种截短的CCR5突变体,该突变体无法在细胞表面表达,而携带这种突变体的人群对于艾滋病毒的感染几乎是完全免疫的。至此,CCR5在艾滋病毒感染中的重要作用才引起人们的重视。
科学家们希望可以据此研发出抗艾滋病毒感染的药物,通过与CCR5的竞争性结合或使CCR5受体分子处于非活性状态而阻断艾滋病毒的入侵,目前已有少量此类抑制剂被研制成功,然而在此之前它们的作用机制仍无法被明确阐明。“我们缺少的就是可用于精确药物设计的CCR5受体分子的高分辨率结构,”吴蓓丽说。
艰苦的探索
2007年,吴蓓丽博士加入Scripps研究所Stevens教授的研究组开展博士后研究工作,致力于艾滋病毒的两种共受体CCR5和CXCR4的结构生物学研究。CXCR4是除CCR5外的另一种艾滋病毒共受体,少数种类的艾滋病毒以CXCR4为共受体,与CD4共同作用完成病毒入侵过程。
Stevens教授说:“从一开始,吴蓓丽的目标就是解析这两种艾滋病毒共受体的结构并据此阐释其功能,这一明确目标一直激励着她的研究工作。”在博士后工作期间,吴蓓丽博士的研究主要集中在CXCR4受体上,她取得的重大研究成果——CXCR4的晶体结构于2010年发表在《科学》杂志上,这些工作为CCR5的结构测定奠定了基础。2011年,吴蓓丽博士加入中国科学院上海药物研究所组建自己的研究团队,在药物研究所的支持下,她继续深入该项研究,进一步探索CCR5的三维结构。
CCR5和CXCR4均属于人体内最大的受体蛋白家族——G蛋白偶联受体(GPCR)。由于GPCR蛋白表达难度大,获得足够量的用于结构研究的蛋白质样品非常困难;并且,由于GPCR蛋白构象不稳定,获得可用于X射线衍射的蛋白质晶体也极具挑战。与CXCR4相比,CCR5的结构解析需要克服更多的困难,但是,凭借解析CXCR4结构的成功经验,吴蓓丽领导她的年轻团队进行了大量的筛选和优化工作,利用一种新的融合蛋白稳定了CCR5蛋白的构象;同时,与上海药物所的蒋华良、柳红和谢欣等三位研究员的研究组在计算机模拟、化合物合成和药理功能筛选等方面进行合作;最终获得了高质量的蛋白质晶体,成功解析了CCR5的三维结构。
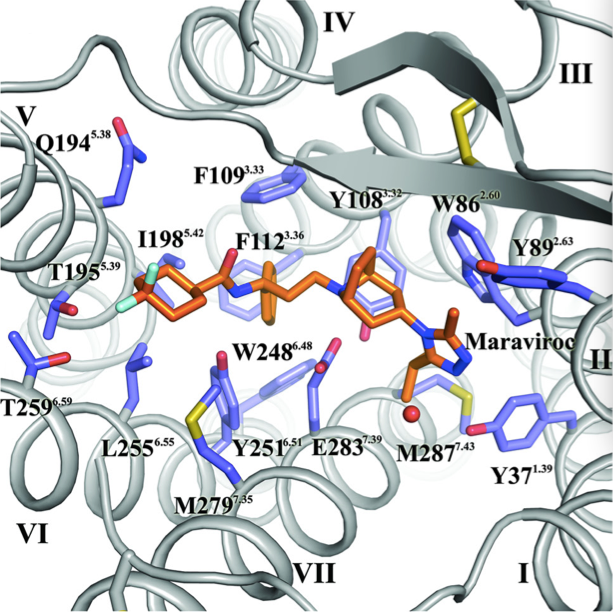
与其他GPCR受体结构解析类似,吴蓓丽的团队还利用一种可与CCR5特异性结合的化合物稳定其构象,这种化合物就是辉瑞公司研制的药物马拉维若(在美国以外地区销售的商标为Selzentry®和Celsentri®),马拉维若于2007年获批上市用于抵抗艾滋病毒感染,这种药物可抑制以CCR5为共受体的艾滋病毒侵染人体细胞。“我们认为马拉维若能够将CCR5的构象锁定在一种非活性状态,希望能够在高分辨率分子水平‘看’到这种构象”,吴蓓丽说。
CCR5的三维结构信息揭示了其抵抗艾滋病毒结合的精细构象,以及马拉维若在受体分子中的精确结合位点。虽然该结合位点与公认的艾滋病毒结合位点不同,且与CCR5天然配体的作用区域也不相同艾滋病初期,但药物分子仍可有效地抑制受体的功能,因此,马拉维若可能是通过间接机制抑制CCR5与艾滋病毒的结合,即不直接与病毒竞争结合CCR5,但通过其与CCR5的结合改变CCR5的分子构象,使其处于艾滋病毒非敏感状态,从而实现阻断CCR5与病毒结合的功效。
中国科技部等部门与美国国立卫生研究院(NIH)共同资助了该项研究。NIH综合医学研究所的Peter Preusch博士这样评论该项研究:“蛋白质三维结构信息可揭示蛋白质与药物分子的相互作用机制,并且有助于新型治疗药物的研发。这一研究成果揭示了马拉维若与抗艾滋病毒药物靶点CCR5的相互作用模式,可以帮助人们在分子水平理解该类药物的作用机理,有助于在生物学角度进一步研究艾滋病毒,并促进此类作用模式的靶向药物研究。”
重要发现

大多数种类的艾滋病毒在侵染人体细胞初期以CCR5为共受体,但是经过一段时间后,病毒共受体转化为CXCR4,使得人体中更多类型的细胞被感染,加剧了病毒在人体内的进一步扩散、加速了疾病的发展,最终导致艾滋病的发生和患者死亡。因此,利用此项研究成果比较CCR5结构与之前解析的CXCR4结构异同,可以为艾滋病毒感染机制研究提供重要线索。
比较结果表明,艾滋病毒对于共受体的选择性可能是由CCR5和CXCR4这两种共受体的结构在形状及电荷分布等方面的细微差异造成的,这些特点对于抗艾滋病毒的药物研发具有重要意义。正如吴蓓丽所说:“了解CXCR4和CCR5的结构信息将加速抗不同种类艾滋病毒的药物研发。”目前,她的研究团队正进一步深入,希望通过解析CCR5和CXCR4与艾滋病毒表面蛋白gp120以及CD4的复合物结构,为研究病毒感染机制提供更多信息。此外,CCR5结构解析之后,上海药物所已组织团队联合攻关,开展基于结构的药物设计,目前已获得抗病毒活性更好的化合物,进一步说明了CCR5结构对于研发抗艾滋病毒药物的重要作用。
除了吴蓓丽和Raymone C. Stevens教授以外,该项研究(Structure of the CCR5 Chemokine Receptor –HIV Entry Inhibitor Maraviroc Complex)的参与者还包括中国科学院上海药物所的谭秋香、朱亚和来自吴蓓丽研究组的赵强、柳红、蒋华良、谢欣等多名研究人员,以及美国Scripps研究所的Gye Won Han、Gustavo Fenanlti、VadimCherezov和加州大学圣地亚哥分校的Irina Kufareva。
该项研究获得了包括科技部“973计划”(2012CB518000、2012CB910400)、美国国立卫生研究院(R01 AI100604、U54 GM094618及其中美生物医药合作研究补充项目)、国家自然科学基金委(31270766、81161120425、81025017)和上海市科委(11JC1414800、12PJ1410500)的资助。



