HIV,是导致艾滋病的元凶,从20世纪80年代首次被发现以来的几十年,全球现存约3700万HIV感染者。在研究如何治愈的道路上,科研人员从未停止脚步治愈艾滋病,但是迎来的一直都是挫折和失败,偶然的治愈案例也难以复制。现在联用抗逆转录病毒药物虽然可以抑制疾病的进展和增殖,但依旧不能完全根除病毒库。
但是,病毒库无法被消灭的魔咒,在2019年7月,第一次被成功解除,天普大学和内布拉斯加大学医学中心的30多名研究人员成功地从实验室老鼠的DNA中根除了HIV-DNA病毒库。
这意味人类多年以来在攻克艾滋病的道路上,终于迈出了一小步。
“我迈出了一小步,但人类迈出了一大步。” ——尼尔·奥尔登·阿姆斯特朗
基因编辑CRISPR
在尝试复制柏林病人的希望逐渐减小时,科研人员将眼光投向了基因编辑技术。比尔盖茨投资的生物医药公司Editas Medicine,开发出了一种名为CRISPR-Cas9的基因治疗法,这种方法旨在利用DNA编辑技术治疗多种疾病,这种疗法很快就被投入了HIV治疗的研究。
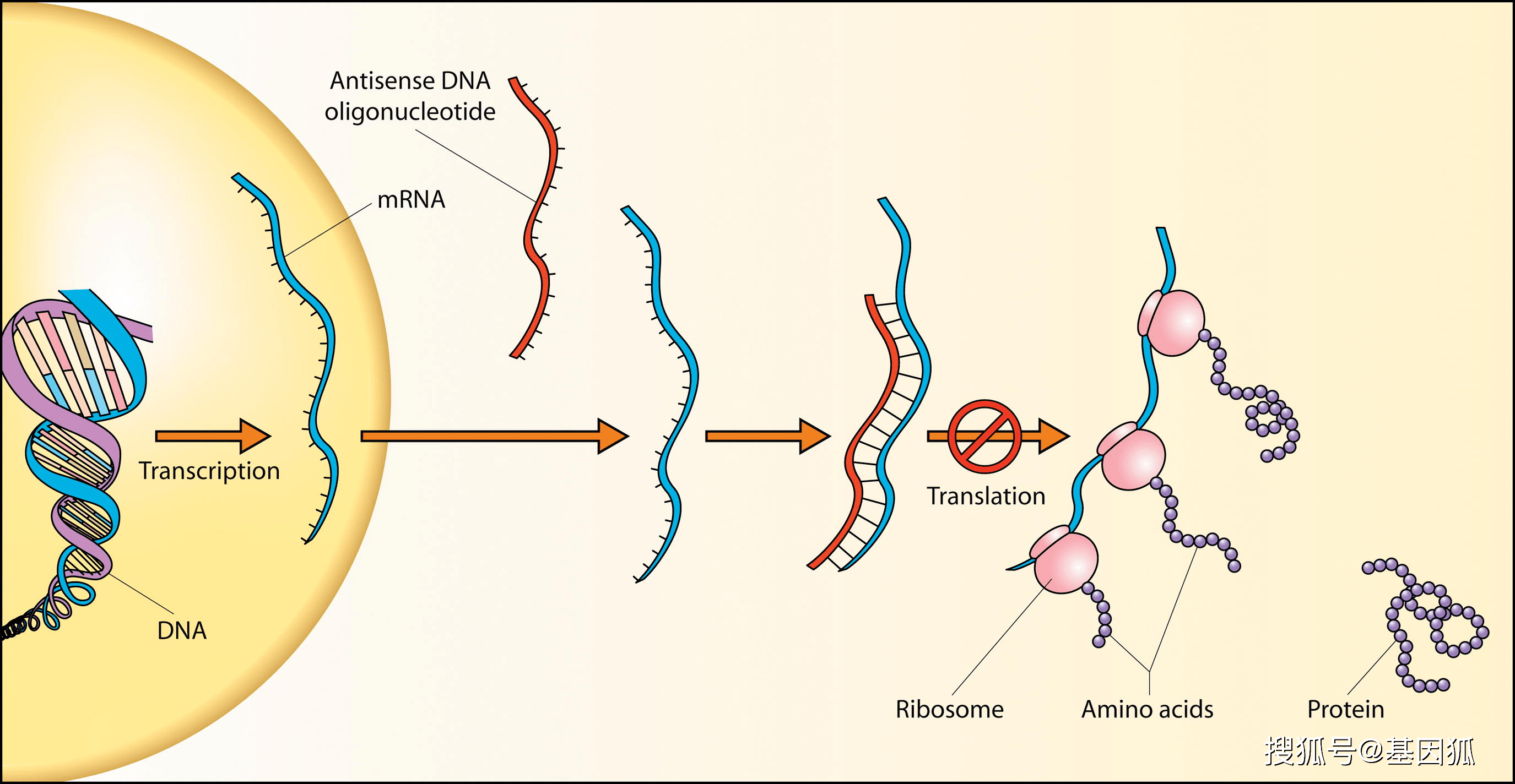
CRISPR/Cas系统并不是人类创造的,这个系统在自然界中广泛存在,其本身为原核生物的免疫系统,使得原核生物用于免疫外来病毒的侵入,同时为细菌提供类似人类免疫应答的获得性免疫系统,即二次免疫。
在原核生物遭遇病毒入侵后,会产生相应的免疫“记忆”。当再次被同种病毒入侵时,CRISPR系统可以识别出外源基因,并破坏外源基因,免疫病毒对自体基因库的干扰。(类似于人类遭受病原入侵后,记忆免疫细胞会识别并记住外来病原体的特征,在再次暴露于同样病原后,能快速、高效地产生大量抗体或功能性免疫细胞,将病原体清除。)
因其能精准的识别和破坏基因这一特性,CRISPR/Cas系统被改造成为了一种高效的基因编辑工具。CRISPR/Cas9第三代基因组定点编辑技术。CRISPR/Cas9系统也是研究最深入,目前在基因编辑方面应用最广泛的技术之一。
但是,新技术的应用必定带来新的隐忧,特别是伦理问题和基因库污染。
2018年11月28日,中国科学家贺建奎在香港举行的人类基因组编辑峰会上发表讲话。他进行了一项枉顾伦理的针对双胞胎基因编辑的实验。
2015年底,美国NIH仍拒绝资助CRISPR/CAS生殖系编辑疗法的研究提案。
2015年12月3日,国际基因编辑峰会发表声明称,基因编辑技术禁止被用于修改人类胚胎以建立妊娠。
《自然-通讯》最新上线了一篇艾滋病研究领域的重磅论文。科学家们开发了一种联合疗法,将持续递送抗逆转录病毒的给药系统与CRISPR-Cas9基因编辑技术相配合。根据官方新闻稿,这种疗法首次从活体动物的基因组中消除了HIV-1的DNA。
研究机构评论说,这项研究“标志着在开发新疗法,治愈人类HIV感染的路上,迈出了关键一步”。
根据联合国艾滋病规划署(UNAIDS)的估计,全世界每一天新增的HIV-1病毒感染者超过5000人。目前,感染者主要依靠各种抗病毒药物进行治疗。抗逆转录病毒治疗(ART)能够有效降低患者体内的病毒载量,同时降低病毒传染的风险。
在科学家们的不懈努力下,现有疗法已经把曾经的绝症变成了可控的慢性疾病,而科学家们还在朝着治愈艾滋病的目标前进。
ART疗法要求感染者终生服药,因为这种疗法可以抑制HIV病毒的复制,却不能将病毒从体内消除。如果停药,体内的HIV病毒会卷土重来,重新复制并促进疾病发展。
而HIV之所以有“反弹”能力,是因为病毒在攻击人体的免疫系统时,会将DNA序列整合到细胞的基因组中,从而藏匿于人体。
要真正消除HIV达到“治愈”效果治愈艾滋病,就要从感染的细胞和组织中去除被病毒整合进去的DNA片段。
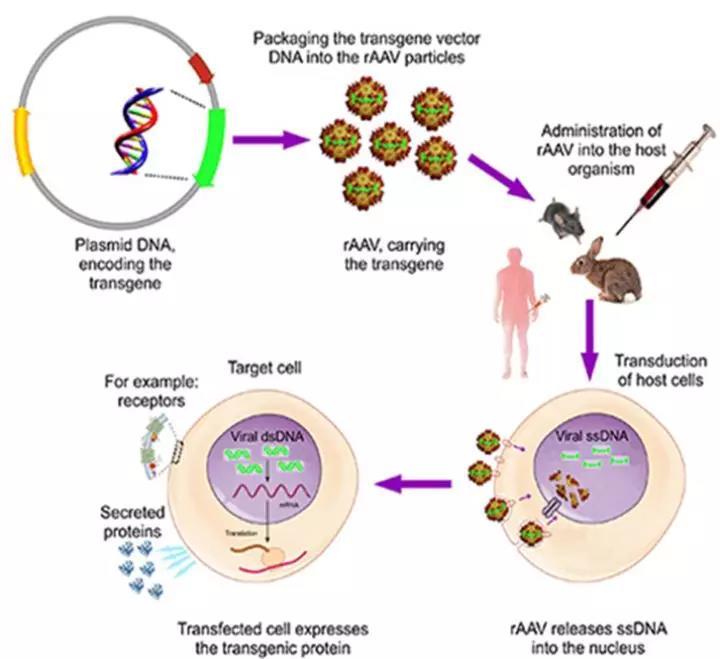
美国内布拉斯加大学医学中心(University of Nebraska Medical Center)的Howard Gendelman教授、坦普尔大学刘易斯·卡茨医学院(Lewis Katz School of Medicine at Temple University)的Kamel Khalili教授及同事开发了一种旨在消除HIV病毒的联合疗法,由一种ART递送新方法和CRISPR基因编辑技术组成。
▲该研究的两位通讯作者Howard Gendelman教授(左)和Kamel Khalili教授(右)(图片来源:研究机构官网)
具体来说,Gendelman教授及其合作者共同开发了一种长效缓释ART疗法,将结构经过改良的抗病毒药物分子包装在纳米颗粒中,由纳米颗粒将药物送入HIV的藏身之处。这种给药方式可以在数周内缓慢释放药物,达到在较长时间内抑制病毒活性的目的。
而Khalili教授团队利用CRISPR-Cas9开发的技术可以在受感染的细胞内“剪去”HIV的DNA片段。当长效缓释ART疗法将HIV病毒的复制抑制在较低水平的同时,CRISPR-Cas9开始发挥作用。
研究团队通过动物实验验证了这种联合疗法的可行性和有效性。他们首先制造了HIV感染的人源化小鼠模型。然后,分两次独立实验,给总计13只确认感染的小鼠施用了联合疗法。
▲感染并施用疗法的研究示意图(图片来源:参考资料[1])
经过连续的治疗,接受治疗以后的5周内,通过多项技术对血液、淋巴组织、骨髓和脑组织进行检测。结果显示,接受联合疗法的小鼠中近三分之一没有检测到HIV病毒,可以被认为小鼠细胞和组织里的HIV病毒DNA被完全消除。
相比之下,单独接受其中某一种疗法的小鼠中,很容易就能检测到HIV。此外,检测结果还显示未检测到CRISPR-Cas9脱靶。
小鼠实验的积极结果显示了这种联合疗法治愈艾滋病的前景,据Khalili教授在研究机构发布的新闻中透露,他们计划开展进一步的研究,在一年内推进非人灵长类动物的试验,并有可能在人类患者身上展开临床试验。



