
阻碍治愈艾滋病的关键障碍是艾滋病毒库,抗病毒治疗能控制病毒复制,却不能消除病毒库。但最近公布的研究报告显示,在感染后早期治疗,艾滋病毒库会较小。
根据本周在第11届国际艾滋病学会科学大会发表的研究报告:在感染艾滋病毒早期开始抗病毒治疗,也就是在免疫系统出现广泛损伤之前治疗的人,艾滋病毒库较小,这可能是提高功能性治愈的希望。
在最初感染后不久,艾滋病毒会在长期静息t细胞上建立一个未激活的持久病毒库。虽然抗病毒药物可以控制病毒复制,但它们不能消除这些潜伏的病毒库,当治疗停止时,病毒库就会开始制造病毒,这也是治愈艾滋病的关键障碍。

开始治疗时的CD4计数
墨尔本大学的Edwina Wright教授和由同事组成的国际团队在START(抗病毒治疗时间策略)试验中,观察了早期开始抗病毒治疗(ART)患者的CD4T细胞计数和病毒库大小之间的关系。
正如2015年那届大会报告的那样,START显示,开始治疗时CD4细胞计数超过500/mm3的人,患病和死亡的风险明显低于那些开始治疗时CD4细胞计数低于350的人。这些发现导致了全球治疗方针的改变,即向所有被诊断为艾滋感染的人使用抗病毒治疗,无论CD4计数是多少。
在这项子研究中,Wright和同事比较了开始治疗时CD4计数为500-599(36名参与者)、600-799(60名参与者)或超过800(50名参与者)的病毒库大小。这些参与者中的大多数(60%)是女性,大多数是黑人,平均年龄约为40岁。
通过观察大约抗病毒疗法三年后收集的样本,他们测量了总的艾滋病毒DNA、一种特定类型的艾滋病毒DNA(2长末端重复DNA)、CD4细胞中与细胞相关的未剪接艾滋病毒RNA,以及使用单拷贝检测血浆艾滋病毒RNA。他们还评估了T细胞活化的标记物(HLA-DR, PD-1和pSTAT5的表达)。
研究人员发现,开始治疗时CD4细胞计数超过800的患者,其HIV DNA总数低于开始治疗时CD4细胞计数为600-799或500-599的患者(分别为每百万细胞16、30、68个)。
虽然在CD4计数最高时开始治疗的患者中治愈艾滋病,总DNA和血浆HIV RNA显著减少,但2长末端重复DNA或细胞相关未剪接RNA的情况却并非如此。
根据HLA-DR测量,在CD4计数超过800的ART患者中,T细胞激活显著降低,但PD-1和pSTAT5表达没有差异。
研究人员还注意到,与年轻人和男性相比,老年人和女性的艾滋病毒DNA总水平较低,但在调整了这些因素和其他因素后,抗病毒疗法启动时较低DNA总水平和较高CD4计数之间的关联仍然存在。但在分别观察女性和男性时,这种关联对男性来说不再明显。
研究人员总结说:“我们的发现表明,在开始ART前CD4T细胞≥800/mm3的艾滋患消除潜在的感染细胞的能力更强,并可能构成一个从介入治疗研究中获益子群。”
广泛中和抗体(bNAb)敏感性和病毒库大小
在另一项研究中,吉利德公司的Brian Moldt博士和同事,比较了在不同感染阶段开始抗病毒治疗患者,体内的病毒库大小和差异,以及艾滋病毒对广泛中和抗体(bNAbs)的敏感性。
目前在艾滋治疗和防治研究中,bNAbs能够识别病毒的保存部分,这些保存部分在不同毒株中变化不大。
研究根据参与者开始抗病毒治疗的时间,把参与者分成了4组:Fiebig阶段I或II(当HIV RNA和p24抗原可以被检测到),Fiebig阶段III或IV(当HIV抗体首次被检测到),晚期急性感染(三个月或以下)和慢性感染(六个月或以下)。
4组分别为16、17、14和17人。超过90%的参与者为男性,他们接受ART治疗3至5年,CD4计数很高(大约700至900)。
参与者接受了白细胞分离术,即抽取血液,取出白细胞,然后将剩下的血液送回身体。
通过这种方法,研究人员收集了外周血单核细胞(T细胞和其他免疫细胞)样本。
使用完整的前病毒DNA测定、总HIV DNA测定和病毒生长定量测定来测量这些细胞中的病毒库。对吉利德的试验性bNAb elipovimab的敏感性是通过HIV包膜基因分型确定的。
研究人员发现,Fiebig I-II和Fiebig III-IV组的总DNA含量较低。晚期急性感染组水平低于慢性感染组,但差异无统计学意义。
此外,与慢性感染相比,在急性感染期间开始治疗的患者病毒差异更低。较早开始抗病毒治疗的人通常对elipovimab的敏感性也更强。

研究人员总结说:“在Fiebig I-IV期间开始抗病毒治疗的患者将是概念验证治疗试验合适的目标群体,因为他们的病毒库的规模和差异都更小。”

猕猴的治疗后控制
最后,巴黎巴斯德研究所的Caroline Passaes博士展示了一项针对猕猴早期抗病毒治疗和治疗后抑制(停止治疗后保持病毒抑制能力)的研究结果。
这项被称为pVISCONTI(“p”代表灵长类动物)的研究使用了一种非人类灵长类动物模型,来评估早期和晚期抗病毒疗法开始对免疫反应和中断治疗后效果的影响。研究的目的是为了在标准化条件下,更多地了解在法国VISCONTI队列和其他治疗后抑制者中发现的病毒抑制潜在因素。
研究人员观察了感染SIV (HIV的猿类表亲)的猴子,比较了12只在初次感染时(暴露后28天)开始联合抗病毒治疗的猴子,12只在慢性感染时(感染后6个月)开始联合抗病毒治疗的猴子,以及17只仍未治疗的猴子。
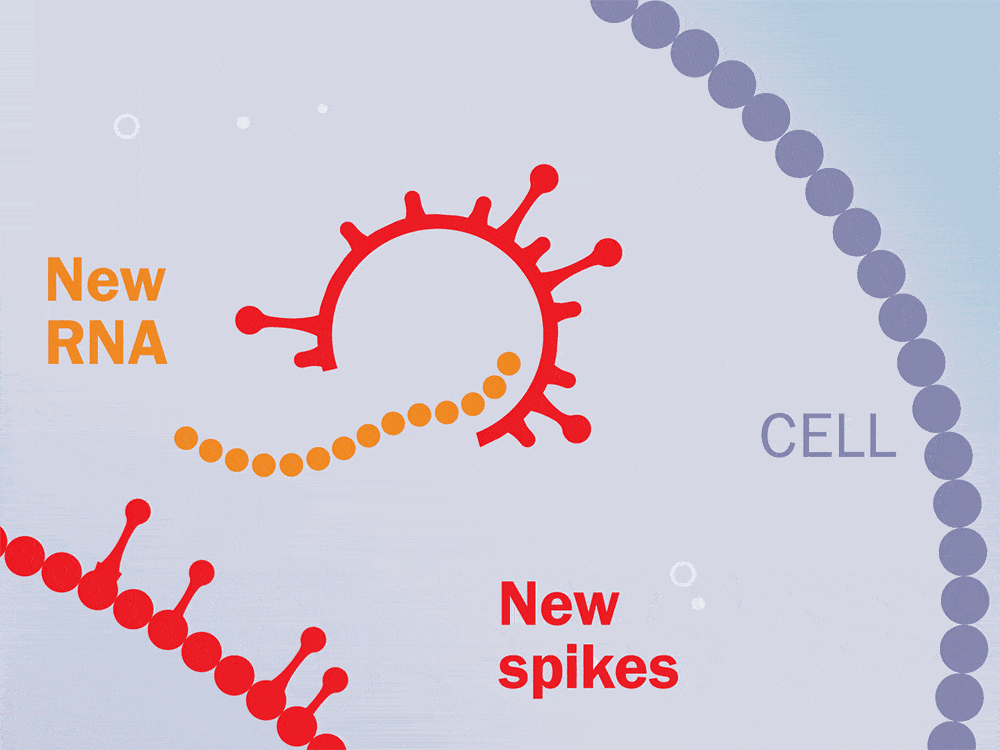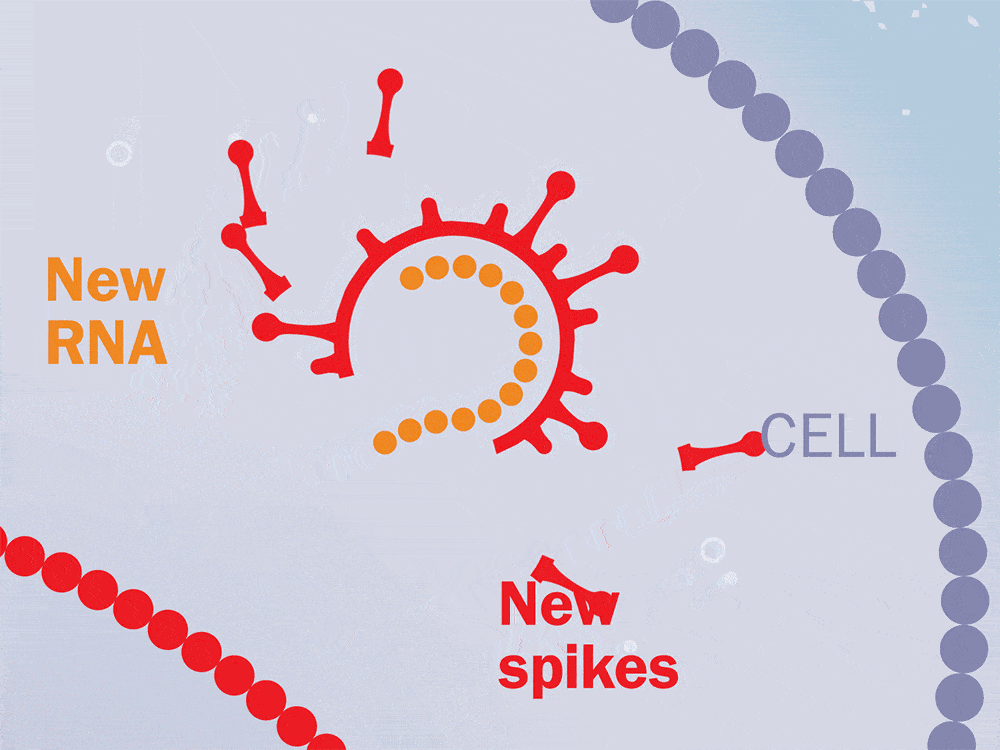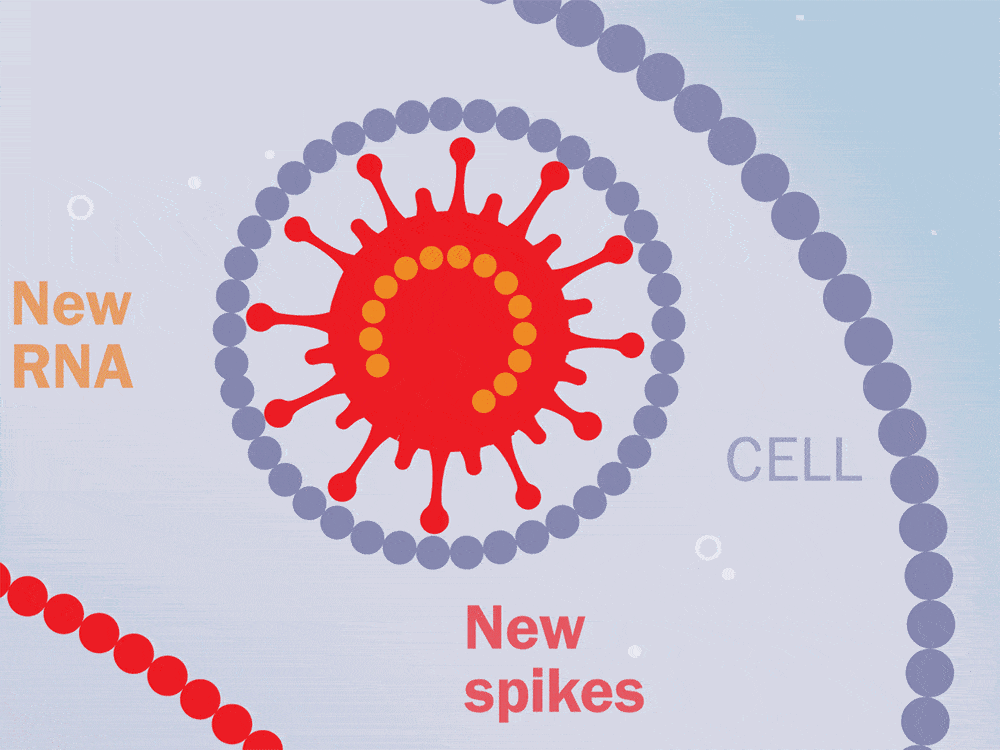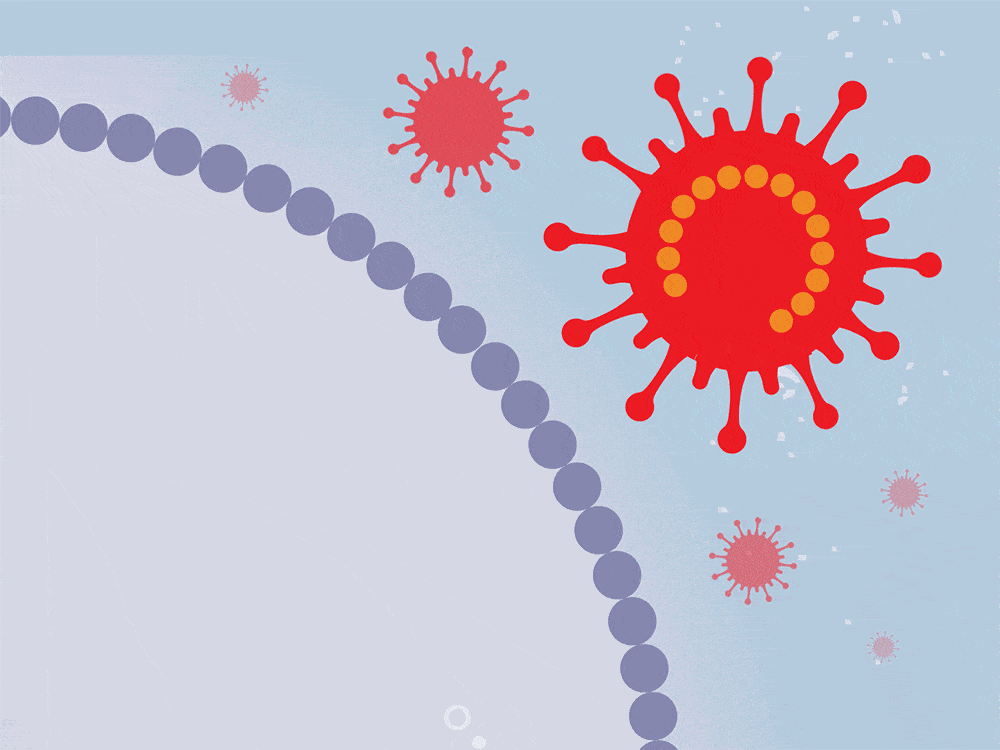
抗病毒治疗持续了两年,在中断治疗后,对这些猴子进行了6个月到1年的监测。在整个研究过程中测量了血浆病毒载量、CD4T细胞水平和CD8T细胞反应。
与初次感染相比,在慢性感染期开始治疗的猴子病毒反弹(定义为超过1000 copies/ml)发生得更快。
此外,在研究结束时,初次感染组有82%的猴子达到了治疗后抑制(定义为病毒载量低于400 copies/ml),而慢性感染组和未治疗组的这一比例分别为25%和12%。
研究人员还注意到,抗SIV CD8 T细胞活性在感染时很弱治愈艾滋病,但在治疗中断后增加了——特别是在初次感染便开始抗病毒治疗的猴子中——这治疗后的抑制者中更强。
“早期联合抗病毒治疗有利于延迟病毒反弹和更高频率的治疗后抑制。”研究人员总结说:“治疗后抑制与促进血液和淋巴组织中强大的SIV特异性CD8 T细胞继发反应相关,这种反应有效地抑制了分析治疗中断后的病毒反弹。



