艾滋病疫苗真的被攻破了?
大家还记得去年一则刷屏消息吗?“某公司艾滋病疫苗研制获得成功,而且100%产生抗体”,引起圈内不小的轰动。艾滋病疫苗真的即将攻破了吗?经过多位权威专家辟谣,发现媒体的报道是偷换概念,我们距离艾滋病疫苗的研制成功还有很长的路要走。不过,现如今艾滋病的免疫治疗再次引起了人们的广泛关注。今天就与大家聊聊艾滋病免疫治疗方面的新进展。


在聊艾滋病免疫治疗之前,我们先回顾一下艾滋病抗病毒治疗。
1996年何大一博士发明了著名的“鸡尾酒”疗法,即高效抗逆转录病毒治疗(highly active antiretroviral therapy,HAART),从此艾滋病由“不治之症”变为可控制的“慢性疾病”。HAART能长期有效地控制患者体内的病毒复制,患者甚至可存活至预期寿命。但其局限在于无法完全清除体内的艾滋病病毒(human immunodeficiency virus,HIV),病毒依然隐藏在一些免疫细胞内,一旦患者停止服用抗病毒药物,病毒又会卷土重来。
因此,艾滋病患者必须终身接受抗病毒治疗,长期治疗带来的诸多不便以及各种副作用也让患者叫苦不迭。寻找能够治愈艾滋病的方法是无数研究HIV科学家们共同努力的方向,而其中一个重要的方向就是艾滋病的免疫治疗。
目前,艾滋病的免疫治疗方向有以下几个方面:
一、基于抗体的抗HIV策略
广谱中和抗体(bNabs)
目前最受关注的是能够直接阻断病毒感染的广谱中和抗体(bNabs)。bNabs主要通过结合HIV-1表面的Env蛋白,从而阻止HIV感染宿主细胞。目前发现的具有远大潜力的中和抗体包括VRC01、3BNC117、10-1074及N6等。虽然这些广谱中和抗体能覆盖90%以上的病毒株,但临床试验发现这些单个中和抗体持续抑制病毒几周后都不可避免的出现病毒反弹。bNabs除了直接结合病毒外,还表现出非中和的免疫调节功能,如产生抗体依赖的细胞介导的细胞毒作用(ADCC)及补体依赖的细胞毒作用(CDC)。最近,有科学家研究设计了针对HIV不同表位的双特异性广谱中和抗体(bispecific bNabs),以求进一步提高bNabs的覆盖率和抗病毒持久性。
免疫检测点阻滞剂(ICBs)
免疫检测点阻滞剂(ICBs)是一类通过调节特异性杀伤性T淋巴细胞活性来清除HIV的方法,最初被应用于肿瘤的免疫治疗。在被HIV感染后,会促使宿主免疫细胞表达出一些免疫抑制分子,我们称之为免疫检测点。免疫抑制分子使免疫系统中CD8+T淋巴细胞的免疫杀伤功能被逐步耗尽。临床上有3个著名的靶点:细胞毒性T淋巴细胞相关蛋白4(CTLA-4)、程序性细胞死亡蛋白(PD-1)及其配体(PD-L1)。目前,针对这三个靶点的抗体药物ipilimumab(针对CTLA-4)、nivolumab(针对PD-1)和avelumab(针对PD-L1)正被应用于抗HIV治疗的研究,从目前的细胞试验及动物试验结果来看,具有广阔的前景。
抗体介导的清除HIV感染的细胞策略
该策略是通过抗体和药物进行偶联(ADCs),通过抗体靶向毒素杀死被HIV感染的细胞,这个策略最初也是来源于肿瘤的免疫治疗。ADCs药物CD4-PE在体外试验能很好的杀死被HIV感染的CD4+T淋巴细胞,但由于肝毒性和未能明显降低HIV病毒载量而未通过I期临床。近年来,科学家将这一策略和广谱中和抗体结合起来,增加其杀伤的特异性。或是与其他HIV感染细胞表面特异性分子抗体结合,如anti-PD-1、 anti-CD32a等, 达到清除HIV病毒库的目的。
二、基于HIV-1治疗性疫苗的策略
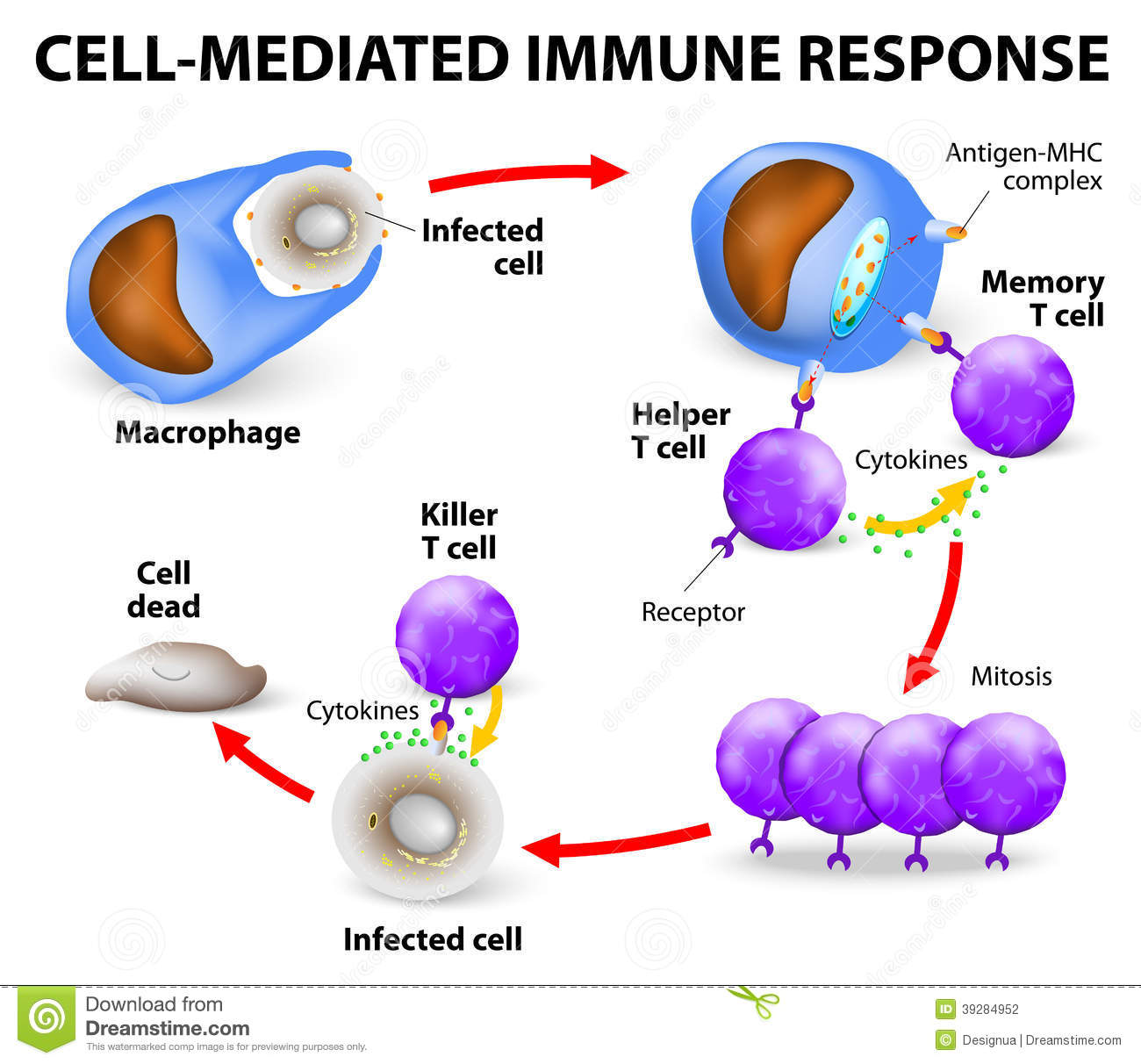
这里需要提到一类被称为“精英控制者”的HIV感染者。有极少数感染者能够长期和病毒“和平共处”,他们的免疫系统能够自然控制病毒的复制,避免病毒对免疫系统的损伤。“治疗性疫苗”的目的就是通过疫苗重新激活感染者的免疫系统,使感染者自发的产生针对HIV-1的特异性CD8+T淋巴细胞,在中断抗病毒治疗后,仍能够对病毒产生抑制作用,实现功能性治愈。一些HIV-1治疗性疫苗在临床试验中发现仅能够产生温和的抑制病毒能力(降低0.2~0.5个log),由于抗病毒效率的不足而导致HIV从被疫苗激活的杀伤性T淋巴细胞反应(CTL)中逃逸。
最近研究人员通过构建改造猴的巨细胞病毒载体,增大了疫苗的应答率,通过这种方法,使得50%的恒河猴在急性期清除了体内感染的SIV。
该结果虽令人鼓舞,但在人身上是否能产生同样的效果还有待临床试验证实。总之,免疫逃逸是目前HIV疫苗面临的主要问题,大量的临床试验结果表明,单独应用HIV治疗性疫苗很难成功治愈艾滋病,需要联合其他的抗HIV治疗策略,增强联合抗逆转录病毒治疗(combination antiretroviral therapy,cART)中断后对病毒的抑制作用。
三、其他免疫治疗方法
α4β7阻滞剂(vedolizumab)可通过阻断CD4+T淋巴细胞表面α4β7分子,限制CD4细胞回归肠道黏膜,从而大量减少暴露于HIV的靶细胞。一项恒河猴SIV感染的研究表明,α4β7单克隆抗体与cART联合使用9个月后,停止cART,继续单独使用α4β7单克隆抗体,仍能降低前病毒DNA(病毒库的主要成分)、增加血液和肠道组织的CD4+T淋巴细胞。基于这个研究成果,vedolizumab目前已进入临床I期研究。
四、免疫治疗与抗病毒治疗相结合
HIV感染形成的病毒储藏库成为彻底根治艾滋病的最大障碍,科学家们试图通过激活并杀伤的策略,实现HIV功能性治愈,但结果发现这种策略虽然能够激活沉睡的被感染的CD4+T淋巴细胞,但并不能有效的降低前HIV-DNA。最近他们改变策略,通过激活病毒库联合HIV治疗性疫苗(Vacc-4x)的方法,发现HIV病毒储藏库减少了38%。此外治愈艾滋病,有研究通过早期抗病毒治疗结合HIV治疗性疫苗(MVA.HIVconsv)的策略,发现36%的感染者在ART中断后仍能维持病毒抑制。
综上所述,大家是不是也觉得要根治艾滋病,单一的治疗方案很难成功呢。也许只有HAART和免疫治疗相结合,同时尝试不同的治疗策略,才能够最终实现彻底根治艾滋病的目标。



