本场直播 免费参加,点击上方链接 马上预约!
近日,FDA批准了蓝鸟生物公司的Zynteglo一次性基因疗法,用于治疗需要定期输血的全部基因型β-地中海贫血。 这是FDA首次批准针对β-地中海贫血患者的基因疗法,对于患者来说,该疗法堪称“改变游戏规则”。
β-地中海贫血是全球最常见的单基因遗传病之一,为了生存患者不得不终身输血治疗,然而这种治标不治本的疗法还会出现因铁过载和多器官损伤而导致的严重并发症。Zynteglo获批的消息一经传出,为这类患者带来了新的希望。 但Zynteglo在美国的定价却令人咂舌,治疗费用高达280万美元,约合人民币1908万元,远超诺华制药脊髓性肌萎缩Zolgensma基因疗法210万美元,一举成为“史上最贵药”,也让患者面对生的希望“望而却步”。
据2021年5月发表的《中国地中海贫血蓝皮书(2020)》数据显示,地贫基因携带者约占全球3.45亿人口,而中国地贫基因携带者约有3000万人,重型和中间型地贫患者人数在30万左右。由于血液资源有限以及铁螯合剂成本高昂,中国地贫患者仅有部分比例能维持规范的输血和去铁治疗, 而Zynteglo疗法1908万元的治疗费用让中国乃至全球绝大部分地贫患者难以企及。对于患者及其家人来说,无疑是更加沉重的打击:看到了活下去的希望,却那么遥不可及。
在杭州医药港小镇,有一家企业——康霖生物,经过长达7年的努力,最近成功治愈2例地贫患者,且数据和疗效远超国际领先的美国蓝鸟生物。此外,康霖生物长期致力于降低基因治疗药物造价技术的研发,目前已经能够大幅度降低地贫基因疗法中关键的载体成本,可使地贫基因疗法为绝大部分患者所及。
作为一家自2015年成立以来始终专注于基因治疗创新药物研发的企业,康霖生物一直以“做患者用得起的好药,创造真正的价值”为己任。研发管线针对的大多是严重影响人类健康的疾病,包括地中海贫血症、艾滋病、帕金森病和血友病等,专注于以技术研发解决临床需求。
今日,笔者有幸邀请到康霖生物董事长兼首席执行官吴昊泉博士,回顾了康霖生物如何一步步攻坚克难,解决基因治疗领域世界性难题的发展历程。
个人简介

吴昊泉博士,康霖生物董事长兼首席执行官。2000年在复旦大学取得博士学位,2003年出国后分别在加州大学洛杉矶分校和哈佛医学院接受博士后训练,2009年在美国德州理工大学健康科学中心获得助理教授职位,2015年晋升为副教授,2018年在美国洛杉矶希望之城贝克曼研究所获聘教授。2015年创立康霖生物,任首席执行官至今。研究领域包括小RNA相关基因表达的调节与感染性疾病,包括microRNA加工、siRNA/shRNA设计、运用siRNA/shRNA治疗艾滋病病毒感染以及基因编辑。在国际知名杂志上共发表30余篇文章,共被引超过4000次。以PI身份拿过6项NIH基金。作为课题负责人承担了国家级重大专项以及浙江省重点研发计划。
1
不忘初心,创新启航
在复旦大学本硕博学习及后续工作期间,吴昊泉博士就开始深耕基因治疗领域,2003年出国做博后、搞研究,直到2018年回国,吴昊泉博士已经在基因治疗领域有着30多年的积淀。作为行业资深老兵,2013年吴昊泉博士敏锐地觉察到这个领域的产业机遇:基因治疗确实已经可以解决许多临床问题。彼时,一颗致力于创新的种子开始萌芽,经过2年的筹备,康霖生物落户杭州钱塘区。“基因治疗是一个百年不遇的产业机遇,作为一个新兴产业,国内外都处于起步阶段,差距并不大,有大量学术研究和丰富的公开数据,我认为在这个领域中国完全有可能成为引领者。”吴昊泉博士表示。
成立之初治愈艾滋病,康霖生物就没有考虑布局仿制类的研发方向。吴昊泉博士沉稳的阐述道:“国内外的学习、工作经历,让我觉得做跟随性的工作意义不大,不过最重要的是,这不是我感兴趣的点。我想要做一些创新型比较强、真正有意义的项目”。康霖生物成立后,吴昊泉博士践行了自己的创新理念,目前康霖生物在研项目均拥有独特的创新点,与全球现有同类项目均有所差异。“在我看来,做到没有人做到过的才是真正的创新,真正的创新并不是国内第一,而是全球第一,这是康霖生物在研项目的终极目标,也是康霖生物致力于创新的初心。”吴昊泉博士说道。
目前,康霖生物在研基因治疗药物4款,包括血友病、地中海贫血症(以下简称“地贫”)、艾滋病(HIV)和帕金森,这4款药物已做完早期研发,部分药物处于IND准备阶段。其中用于治疗地贫的KL003进展最快,今年5月公布的临床研究结果显示,2名儿童患者已被完全治愈,疗效远超该领域国际上最领先的美国蓝鸟生物同类药物Zynteglo。此外,早在2017年康霖生物艾滋病功能性治愈的项目就获得了国家重大专项的立项支持,这也是国家第一次把艾滋病的功能性治愈写进指南。另外,康霖生物血友病和帕金森管线也在顺利进展中。
2

新兴产业,优势凸显
每一个技术都有自身的特点和能解决的临床问题,基因治疗最显著的特点是长效性和局部治疗。目前,大多数传统治疗方式是在直线功能层面即蛋白质层面进行治疗,由于蛋白质会不断降解和代谢,对于遗传性疾病或基因功能缺失类疾病,患者通常需要终身用药,弥补对应基因的功能。但基因治疗则完全不一样,其通过在靶细胞中导入基因,使之具备对应蛋白质的生产能力,从而在基因层面解决源头性问题,达到一次给药,长期有效的目的。
地贫是一种单基因遗传病,在中国乃至众多发展中国家患者数量庞大,导致该疾病的原因是编码β血红蛋白的基因产生突变,而这种突变会导致两种疾病,地贫和镰贫(镰刀型贫血症),患者只能通过输血、排铁、切脾、造血干细胞移植等手段来进行干预治疗,目前尚无有效治疗药物。康霖生物基因疗法KL003通过导入编码β血红蛋白的基因,在体外改造造血干细胞后输入患者体内,从而可以源源不断的产生正常的血红细胞,达到一次治疗,终身治愈的效果。
除了遗传病,基因疗法还可以治疗基因功能缺失类疾病,比如糖尿病和帕金森病,导致这类疾病的原因是对应基因的功能缺失。当大脑中产生多巴胺的神经元凋亡过多,导致多巴胺浓度降低,就会引发帕金森症状,通过基因治疗,恢复大脑中纹状体产生多巴胺的细胞功能,即可以达到功能性治愈疾病的效果。
除了长效性,相较于传统治疗的全身性分布,基因治疗还具有局部精准改变靶细胞功能的特点。“如果说全身性疗法是全面突击的话,那基因疗法则是单点爆破。传统小分子药或大分子药通常是全身分布,真正到靶细胞的药物只占极少部分,但基因治疗在这方面非常具有优势。针对地贫患者,只需要改造造血干细胞;针对帕金森患者,只需改造纹状体内的细胞产生多巴胺,基因治疗不会对患者的其他部位产生影响。”吴昊泉博士表示。
作为新兴产业,基因治疗仍处于发展初期,每一个进步都非常艰难,“科学的发展是指数型的治愈艾滋病,新技术都会经历漫长的积累期,这样才能为后面的爆发蓄力,这个规律与文化的发展十分相似。”吴昊泉博士介绍到:“基因治疗领域也是如此,现在的基因治疗很稚嫩、存在很多问题,但随着技术的不断发展,基因治疗通过与抗体药、小分子药等领域的协作,加之自身独特的优势,未来一定可以解决更多的临床问题。”
3

攻坚克难,全球领先
基因治疗具有光明的前景,但也存在很多目前还难以解决的问题。“这是新事物发展的规律,问题多是好事,最可怕的是不知道问题在哪,基因治疗目前遇到的问题越来越多,但这也正说明我们对基因治疗的了解和认识越来越深。”吴昊泉博士表示。
地贫是基因治疗领域研究得比较多的疾病,但治疗过程中造血干细胞的干性损失仍然是一个国际难题,目前全球没有任何机构可以很好地解决这个问题。“其实,造血干细胞是人类认识比较早的一类干细胞,骨髓移植移植的就是造血干细胞,但目前对造血干细胞的界定仍然存在问题,导致我们无法判断什么才是真正的造血干细胞。”吴昊泉博士解释道:“干细胞需要在独特的环境下才能保持干性,但在体外基因转导过程中,目前还无法模拟这种环境。有多少干细胞发生分化,真正的造血干细胞占比多少,我们无从判断,包括我们成功治愈的2位患者,输入体内的造血干细胞到底有多少也是未知的。”吴昊泉博士笑着说道:“听起来不可思议,但科学进步就是这样,在未知中不断探索和前行”。
谈及攻克干性损失问题的重要性,吴昊泉博士严肃的说道:“在体外培养过程中,干性损失普遍存在,这是世界性难题,但造血干细胞对重建地贫患者的血液系统至关重要。造血干细胞含量的多少将直接影响患者的疗效,尤其是干细胞回输体内后植入时间的长短。这个问题在所有基于造血干细胞的基因治疗中也存在,如免疫缺陷疾病、溶酶体储积性疾病等的基因治疗”。
令人振奋的是,在这个关键性问题上,康霖生物已经实现技术突破。临床数据显示,2位地贫患者不仅被治愈,而且造血系统的恢复也极其迅速。相比于该领域国际最领先的蓝鸟生物的临床试验数据,康霖生物KL003疗效提升显著:粒细胞植入时间康霖生物为10天和15天,蓝鸟生物平均25.25天(范围:16-38天);具有凝血功能的血小板植入时间康霖生物为14天和19天,蓝鸟生物平均50.5天(范围:20-94天)。康霖生物KL003造血系统的植入时间已与正常骨髓移植时间持平,各项指标远优于国际领先的美国蓝鸟同类产品,有效降低患者感染和出血风险,减少了住院时间。
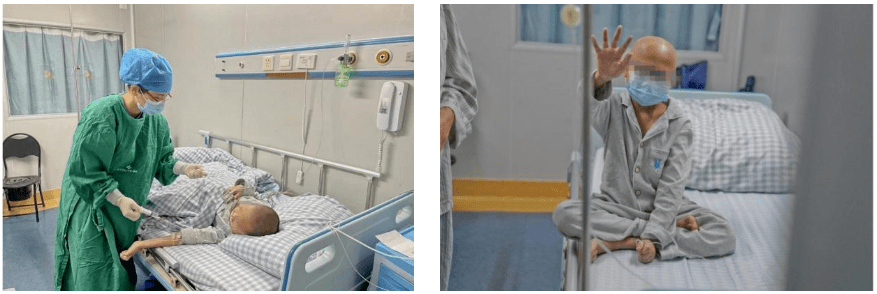
图源:康霖生物
此外,在最终疗效上,康霖生物KL003更是让蓝鸟生物望尘莫及。在1例完全无法产生血红蛋白的重症地贫患者中,治疗后血红蛋白浓度在90天后就恢复到正常水平,而蓝鸟生物一二期临床试验中治疗的9例最严重重症患者,没有一例血红蛋白达到正常水平。蓝鸟生物研发30年没有解决的问题,康霖生物现已成功攻克。
目前,用于治疗地贫的基因治疗药物造价高昂,已上市的仅有蓝鸟生物Zynteglo疗法,但其高达280万美元的价格是全球绝大部分患者无法负担的。康霖生物长期致力于降低基因治疗药物造价技术的研发,目前已经能够大幅度降低地贫基因治疗中关键的载体成本,致力于使地贫基因治疗药物成为绝大部分患者用得起的好药。
“地贫是危害人类最严重的单基因遗传病之一,治疗过程费用高、也很痛苦,即便如此患者通常也无法存活到成年,所以我们的患者都是少年儿童。在研究过程中,我们也看到许多小患者,还没来得及好好认识这个世界,就早早的离开了。我们非常希望能尽快将这些技术应用到这些孩子们身上,让他们也能拥有一个完整的人生。”吴昊泉博士满怀遗憾的说道。
4
与焦虑相伴,为患者而战
走在这条并不平坦的创新之路上,吴昊泉博士却直言自己非常享受这个过程:“对我来说,早期研发是一个非常愉快的过程,不断的解决新问题、世界性难题、探索未知,是非常快乐的。也正是因为有这些令人愉快的经历,才会有现在的康霖生物”。
吴昊泉博士也坦言在企业发展过程中,也曾遇到许多让他有挫败感的时刻:“比如融资,这方面不是我擅长的领域,但对企业的发展、项目的推进非常重要,仍然要坚持去做,这方面带给我的挫败感很强,强烈到让我都有点焦虑症了,”吴博士笑着说道:“我想,如果我们融资能融得更好一点,走得更快一些,也许某个生病的小朋友就能早点用上这个药物,就能多挽救一个年轻的生命。就像我们治愈的这2个孩子,如果没有接受治疗,他们也没办法存活多久,特别是那个严重地贫的孩子。”

“不过,后来我也释然了,研发的道路更加适合我,融资和企业运营方面我仍需不断学习,也可以找更合适的人来做,虽然我还是会焦虑,但我仍然坚持想把这个药做成。人生病之后是非常痛苦的,康霖生物有国际前沿的技术,疗效也远超国际水平,实际上是可以帮助更多患者的。未来,我们仍然会坚持一步一个脚印,争取把我们的创新产品做成FIC、BIC,为全球更多患者提供用得起的创新疗法。”吴昊泉博士坚定的说道。
接下来,康霖生物的发展重点是将4个项目的临床和成药推进,这在这个过程中,融资是至关重要的一个需求,创新药在前期是没有收入的,“无论如何,我们都会坚持下去,对未来也充满信心。在康霖生物7年的发展历程中,我们始终牢记初心——为患者创造真正的价值,我们相信在为患者创造真正价值的同时,肯定也能为社会和我们自己创造价值。‘为患者做好药,创新造就真正的价值’这是我们的核心价值观,也是我们全员一直在做的事情。”吴昊泉博士表示。
5
同心协力,未来可期
谈及基因治疗产业未来的发展,吴昊泉博士表示:“2013~2018年国内基因治疗领域发展缓慢,国外发展如火如荼,国内外差距较大。随着基因治疗产业快速延伸,2018年至今,国内产业相关进展如雨后春笋般出现,发展非常快,资金投入和政策支持力度越来越大,国内外发展差距有望逐步缩小。保持这种发展势头,优化产业环境,朝着国际领先水平奋进,中国基因治疗产业发展空间巨大”。
不过,在国内医药产业大环境下,内卷无法避免,基因治疗领域也一样。过去几十年,国内大部分资源集中在仿制、跟风类药物上,例如PD1等热门药品,经常有几十上百家企业布局,每一个项目的背后是几十上百亿的投入、是几千甚至几万人夜以继日的努力,实际上这些仿制药方向看起来确定性高,但这些人才和资金的扎堆,将会带来什么后果?吴昊泉博士担忧的说道:“在我看来,这将严重制约行业发展。回顾近几十年中国创新药开发历史,我国自主研发的真正意义上的创新药极少,与投入不成比例,原因主要在于绝大部分资源被投入到了仿制药。投入到创新药领域不一定能够成功做出一个创新药,但是投入到仿制药,肯定做不出一个真正的创新药”。
优化产业环境,仅一方力量远远不够,需要整个产业链各方面的共同协作,包括投融资、CXO服务、专利等方面。最重要的是,创新药的开发逻辑需要被正视和认可。“目前社会对创新药存在很多误解,我们公司成立7年还没拿到IND的项目,因此不被看好。但在创新药开发过程中,一般情况下早期研发过程平均需要5~6年,这还不包括后续的临床前评价、临床试验等环节,小分子药是这样,更不用说新兴的基因治疗领域,创新药开发需要解决许多未知的问题。”吴昊泉博士介绍到:“蓝鸟生物做创新药30年,上市药物有3个,并且还存在一些缺陷和问题,比如造血干细胞干性损失问题、无法完全治愈重症地贫等。所以,创新药开发并不是一个简单、容易的事情,我们对这个行业要有正确的认识。”
过去几十年的发展经验表明,仿制和跟风长远来看并不是一条康庄大道。随着社会对创新药的理解和认识逐步加深,大部分资源将会向真正的创新药倾斜,这才是正确的方向。“只有方向对了,所有的努力才有意义;方向错了,再多的努力只会错得更远。”吴昊泉博士表示:“现在是生物医药的大好时代,新知识层出不穷,许多都可以应用到医药领域,这是我们的机遇。另外,中国在生物制药产业上,资本和人才高度集聚,只要方向对,一定能创造更高的价值。”
一个真正的创新药带来的往往是几十上百亿,甚至上千亿美元的收入,在高额经济利益的推动下,全球政府、企业都会使出浑身解数。尽管目前中国制药业存在各种各样的问题,但随着现实社会不断的暴击以及整个社会风气的转变,产业环境的优化,中国的创新药仍然充满希望。



