首先,我们已经知道目前唯一一位治愈(或称长期缓解)的艾滋病患者是2009年的柏林病人。
然后,我们还知道柏林病人是因为移植了HIV无法亲和的CCR5突变的骨髓干细胞而治愈的。
那我们开始分析这篇论文,移植的数学模型分析貌似还没人写过,后面会详细论述。
本论文是针对2019年复制柏林病人治疗方案的伦敦病人的后续报道,而结果是喜人的:在干细胞移植30个月后长期的缓解。作为第二列成功治愈的患者,是很令人振奋的结果。
所谓的长期缓解,作者利用一系列的超级无敌灵敏的很多种检测手段分别检测了患者的血浆、精液和脑脊液样本的HIV-1 RNA 载量艾滋病治愈,均低于检出限。HIV-1感染的薄弱环节肠道淋巴结样本经过检测也为阴性。并且利用病人体内提取出来的外周血淋巴细胞来进行了一系列的病毒感染实验,说明体内的免疫系统已经完全重建并且无HIV-1特异性免疫反应。
研究者认为这些特征可以基本宣称该患者的HIV已经治愈,后续研究计划做一年两次的病毒载量检测在治疗撤离后60个月内,仍需要每年一次的检测直到120个月。
嗯,可以说是很严谨了。
论文主要内容介绍完毕,但本文的重点才刚刚开始。
这篇文章更重要的一点是提出了一个数学模型。即为移植以后供体嵌合率与HIV终生缓解的概率之间的关系。
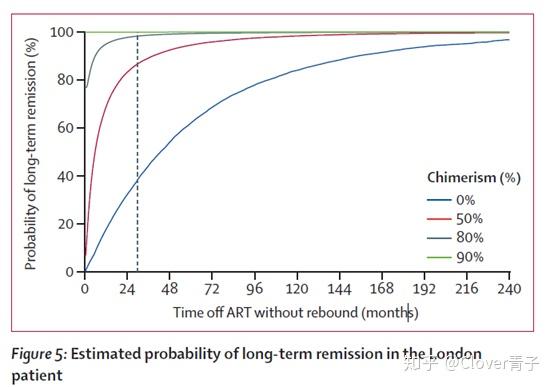
来自[(20)30069-2]
CCR5突变的外来移植---供体干细胞;CCR5野生型的病人的干细胞---受体干细胞;这里的嵌合率就是指受体干细胞被外来移植的具有HIV-1不亲和的细胞完全替代的比率。横坐标是解除抗逆转录病毒的药物以后的时间长,单位是月份。横坐标是长期缓解的比例。
从图中可以看出两点:
1. 在供体嵌合占HIV靶细胞总数80%的情况下,终身缓解(治愈)的概率为98%,在供体嵌合占90%的情况下,终身缓解的概率大于99%。
2. 嵌合程度越高,到达缓解状况所需要的时间也越短。
用基因编辑细胞再移植的治疗手段CCR5突变到达的嵌合比例有多少呢?
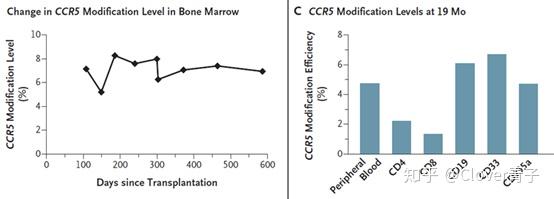

来自从左图可以看出被改变的CCR5水平还不到10%,右图是不同的免疫细胞中的比率,均低于10%。[DOI: 10.1056/NEJMoa1817426]
从去年北大邓宏魁组的数据可以看到,甚至不足10%,这也能解释为何该病人一解除抗逆转录病毒药物,HIV-1载量会迅速反弹。因此基因编辑这条路有多任重道远啊。
虽然坐牢的贺建奎编辑的胚胎能够达到100%的嵌合,但是伦理还没走到那里去,况且副作用和脱靶效应仍然未知,这样的行为是过于激进了。而基因编辑效率和安全可靠的手段是今后需要研究的重点。
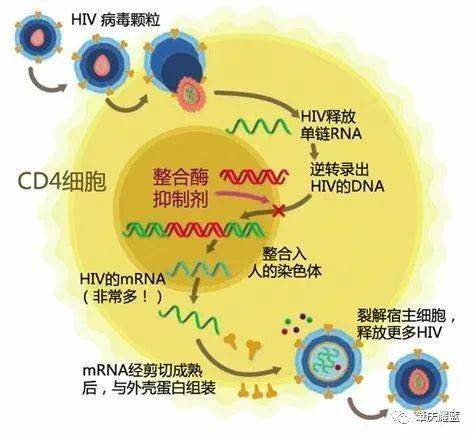
这个数学模型是基于什么理论构建的呢?在排除了移植时全身辐射或者抗移植后排异反应药物两个因素之后,作者提出了移植病人在抗逆录病毒药物中断后HIV不出现反弹的两种机制:
1. 移植后原本病毒载量的减少。(药物施用清空体内原本的“化石”HIV-1)
2. 减少亲和病毒CCR5易感靶细胞的分数比例,因为移植的供体CCR5Δ32 /Δ32细胞无法被HIV感染。(从受体上阻断“化石”HIV-1感染细胞的重生之路)
如何理解上述两种机制,针对第一条,笔者查阅到了几篇移植CCR5野生型的供体的文献,一共有八位患者。2013年两位,2018年六位,是两个独立研究。
虽然这八位患者最后都没有治疗成功(多数是HIV-1反弹,也有一位死于移植后的并发症),但是他们的结果证明就算是移植野生型供体,在抗逆转录病毒的治疗中断后,也可以在长达30周的时间里病毒不产生反弹。
这完全可以用机制1来解释,异基因造血干细胞移植可能导致HIV-1病毒库显著、持续的减少,等到移植以后,再配合一段时间的抗逆转录药物治疗,将体内原本的HIV-1载量完全清零。等待供体的未被感染全新免疫系统在患者体内重建。尽管病毒库规模变得很小,但受感染的组织或细胞结合病毒仍然存在或者隐藏在巨噬细胞等存活时间较长的宿主。这些残留的少量感染细胞的持续存在似乎足以重新点燃HIV-1的复制。
结合机制1和2就是柏林病人和本文中伦敦病人的情况,从结果看起来预后是更好的。
但还是需要警惕HIV的逃逸现象,2014年,一位针对27岁HIV患者的研究显示,病毒在移植后产生了逃逸机制,对该患者HIV-1变异的基因型分析显示,干细胞移植前主要的r5型HIV向移植后的x4型HIV转变。这种向性转变可能是由CCR5 delta32突变的干细胞纯合移植驱动的。本病例突出表明,CCR5突变的移植治疗策略可能使病毒产生型变,导致治疗无效化。2015年,另一位37岁的患者利用脐带血移植,达到了体内T细胞的完全嵌合,但遗憾的是该患者死于淋巴瘤,所以这个患者的后续研究只得停滞了。
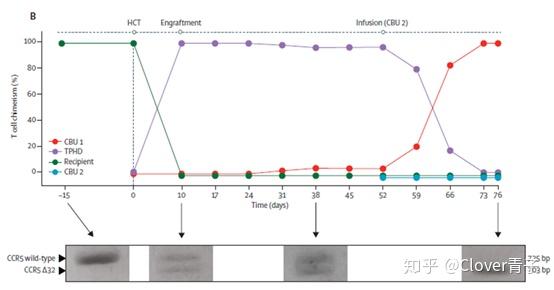
从蛋白检测的结果可以看出,移植以前只有野生型CCR5的条带,而移植后76天,全部就被CCR5Δ突变型所取代了。
作者在讨论中写道,数学模型表明,如果超过80%的靶细胞是供体来源的,那么在29个月时没有反弹,缓解(治愈)的可能性是98%。当嵌合率高于90%时,模型中的治愈几乎是确定的。只要目标细胞的关键部分得到保护(例如达到嵌合的关键百分比),感染就不可能呈指数增长。
但是目前的病例数仍然较少,且个体差异巨大(与伦敦病人接收同样治疗策略的队列共有36人,但最后就一个人成功了)。数学模型还是需要实践的检验艾滋病治愈,但是作为第二个记录成功的CCR5Δ32 /Δ32异体移植患者,本案例向我们证明了该思路的可行性。但移植的合适配型很难找,在CCR5基因编辑可作为HIV-1的可扩展治疗策略之前,仍有基因编辑效率和可靠的安全手段等几个障碍需要克服。
若问我离攻克艾滋病还有多远,我指着大海的方向。
去年北大邓宏魁教授基因干细胞编辑CCR5骨髓移植的实验最终没有获得成功,写过这个答案,感兴趣的可以读下。
参考(20)30069-2(20)30069-2(20)30069-2



