艾滋病(AIDS)是由艾滋病病毒(HIV)引起的一种人类免疫缺陷疾病,由于一直缺乏有效的治愈手段,当前主要通过抗逆转录病毒疗法(ART)来控制HIV的复制和感染,但这往往不能治愈该疾病。近日,著名病毒学期刊Journal of Virology发表了一篇综述:Advances toward Curing HIV-1 Infection in Tissue Reservoirs,系统介绍了治愈HIV-1感染的进展,并对当前艾滋病治疗策略的新方向进行了阐述。

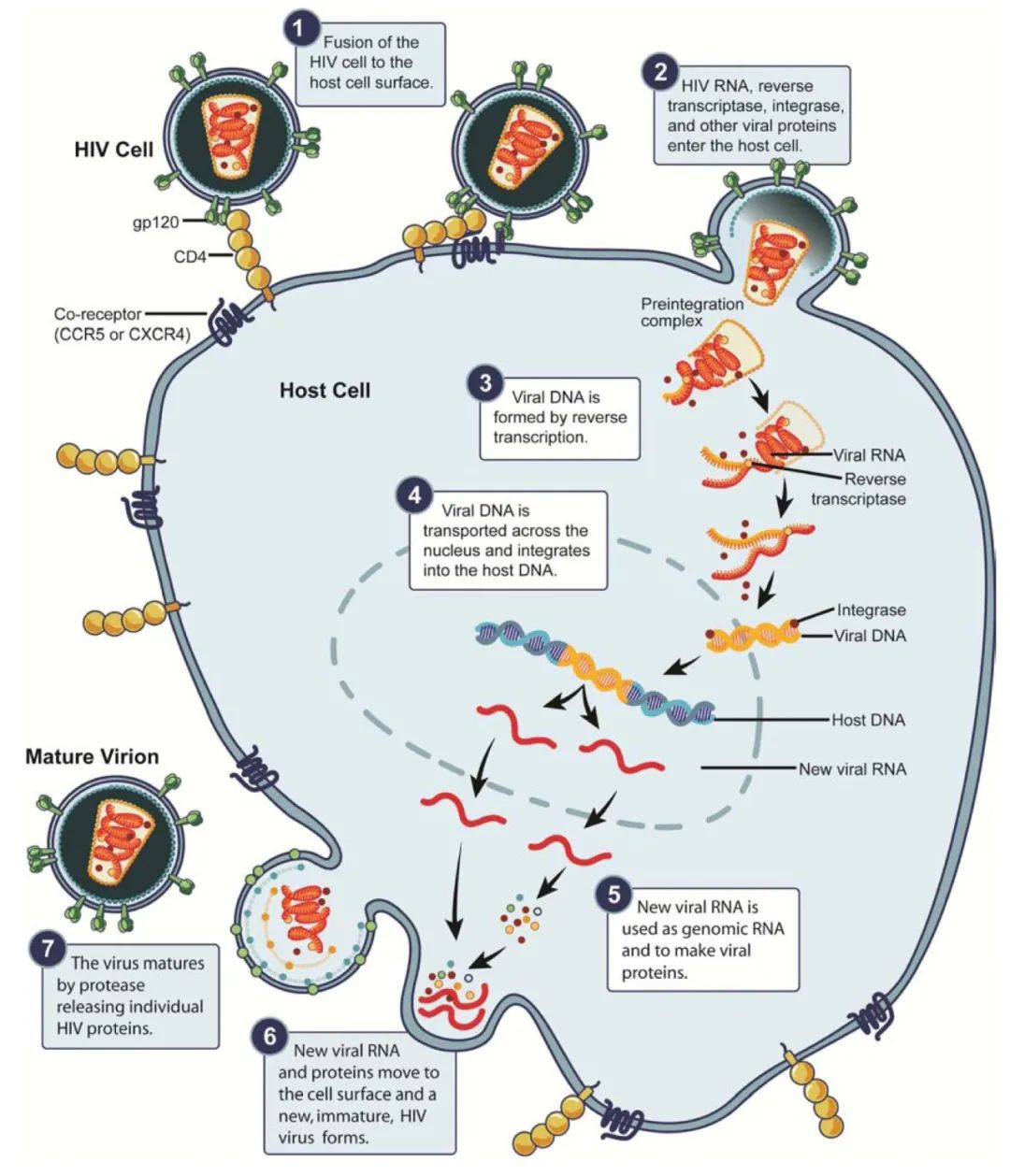
HIV持续存在于潜伏感染的CD4+ T细胞中,并整合到宿主基因组中直至细胞死亡。目前,针对艾滋病的抗逆转录病毒治疗主要有六大类抗病毒药物分别为:核苷类逆转录抑制剂、非核苷类逆转录酶抑制剂、蛋白酶抑制剂、整合酶抑制剂、融合酶抑制剂、辅助受体拮抗剂。
1987年,美国食品与药品管理署批准了第一种抗逆转录病毒药物——齐多夫定上市。齐多夫定是世界上第一个获得美国FDA批准生产的抗艾滋病药品。之后,美籍华裔科学家何大一于1996年提出了“鸡尾酒疗法”,即“高效抗逆转录病毒治疗”(HAART)。通过三种或三种以上的抗病毒药物联合使用来治疗艾滋病,减少单一用药产生的抗药性,最大限度地抑制病毒的复制,从而延缓病程进展,延长患者生命。
尽管,这些年来无数科研人员为根除艾滋病毒作出了巨大努力,但在实现治愈方面仍然面临着巨大挑战。关于艾滋病治愈策略的历史就是一个重复的失败和错误的历史。当抗逆转录病毒疗法第一次被引入时治愈艾滋病,人们认为随着治疗时间的延长,艾滋病毒DNA库的大小就会逐渐减少,病毒最终也会被清除。然而不幸的是,尽管实施了抗逆转录病毒治疗,但艾滋病毒几乎无限地在静止的CD4 T细胞和组织库中持续存在的能力并没有得到充分的重视,这些直到后来才得到充分的认识。
艾滋病毒治疗策略的新方向
HIV-1缓解策略的目标是通过(1)重新激活潜伏的病毒,同时改善抗HIV免疫反应以消除受感染细胞,来减少具有复制能力的储存库的大小;(2)通过对细胞进行基因工程改造,使其对HIV感染具有抗性,或(3)诱导表观遗传变化或染色质重塑,以永久性阻止病毒基因组的转录激活。
检查点抑制剂疗法
免疫检查点分子是调节免疫反应的细胞表面受体。刺激性免疫检查点蛋白可提供共刺激信号,从而增强免疫激活,而抑制性免疫检查点分子会负面调节免疫细胞功能,并在解决免疫反应和维持自身耐受性方面发挥重要作用。在包括HIV感染在内的慢性病毒感染期间,免疫细胞上抑制性检查点分子的上调会导致T细胞衰竭,其特征是效应子功能丧失和无法响应抗原而增殖。检查点分子富集在HIV感染的CD4 +接受ART治疗的个体中的T细胞以及表达这些分子的细胞数量与T细胞病毒库的大小紧密相关。
此外,诸如程序性细胞死亡1(PD-1)和细胞毒性T淋巴细胞相关蛋白4(CTLA-4)等共抑制性分子可作为低水平HIV / SIV病毒复制的生物标志物,并且这些分子的体外阻断作用得以恢复CD4 + T细胞功能。接受检查点抑制剂作为共病癌症免疫治疗的艾滋病毒感染者免疫功能增强,细胞相关的艾滋病毒DNA稳定下降。这些报告表明,T细胞检查点对慢性感染的治疗有希望用于艾滋病毒宿主的治疗策略。
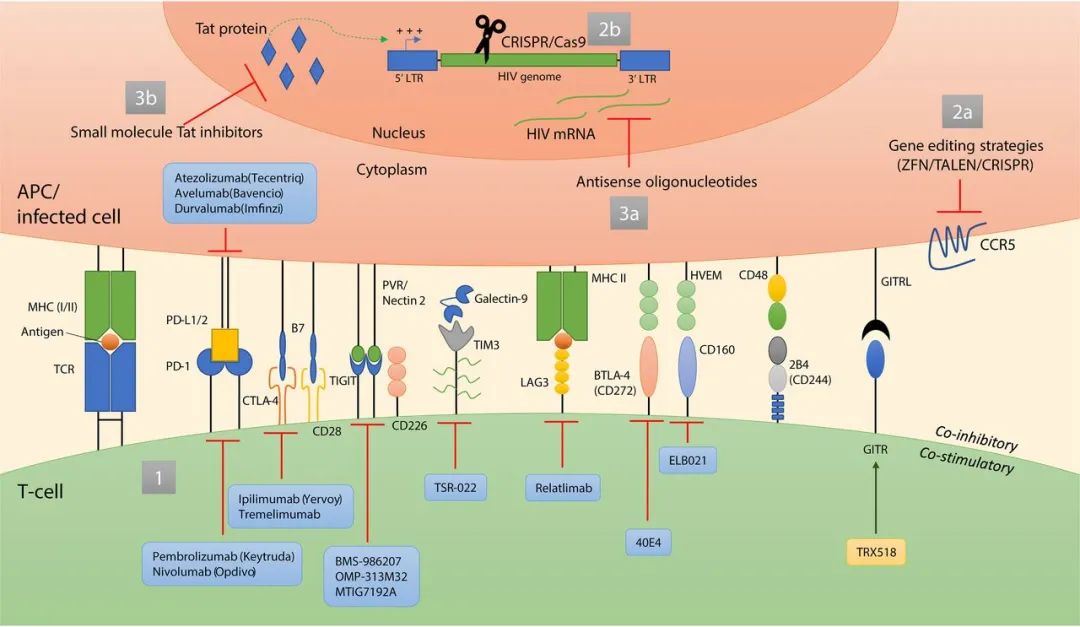
基因编辑技术治疗艾滋病
近年来兴起的利用基因编辑技术治疗艾滋病,是一种富有希望的策略。但是基因编辑技术目前所面临的伦理问题,以及以CRISPR-Cas技术为代表的系统递送和脱靶效应也是不得不需要慎重考虑的问题。
2018年11月26日,贺建奎团队对外宣布,一对基因编辑HIV辅助受体CCR5的婴儿诞生,在学术界引发了一次“大地震”。随后查明,该事件系贺建奎为追逐个人名利,自筹资金,蓄意逃避监管,私自组织有关人员,实施国家明令禁止的以生殖为目的的人类胚胎基因编辑活动。该事件也再次引发了对未来基因编辑技术发展的伦理问题讨论。
此外,邓宏魁等人世界首次利用CRISPR/Cas9基因编辑手段编辑造血干细胞并移植进艾滋病和急性淋巴细胞白血病患者对其进行治疗的案例。初步证明了基因编辑造血干细胞在临床应用中的可行性与安全性。不过,由于其较低的基因编辑效率,使得本研究并未彻底根除HIV-1病毒。
疫苗研发
据艾滋病规划署估计,目前全球预计有3800万艾滋病患者。因此,疫苗接种仍然是全世界控制艾滋病毒感染的最佳和最具成本效益的选择。但是近四十年来,进入临床试验的HIV疫苗有100多种,然而尚无一款有效的HIV疫苗投入临床应用,与之相对应的是数以亿记的研发投入资金。究其原因,在于HIV病毒特有的病毒学性质导致了目前的困境。
首先,对HIV的研究缺乏有效的动物模型,HIV只能感染人类,常规的小动物实验模型,如小鼠、兔子等都不太适合用来评价疫苗效果。
第二、HIV病毒的高度变异性:抗原漂移和抗原转变,也让诸多疫苗难以提供有效保护。
第三、艾滋病的窗口期非常短。相关研究表明清除病毒的最佳时期就在窗口期。然而,对于HIV-1病毒而言,仅在感染大约6天后病毒就会大量复制,然后通过循环系统扩散形成全身感染,因而使得疫苗保护效果并不明显。
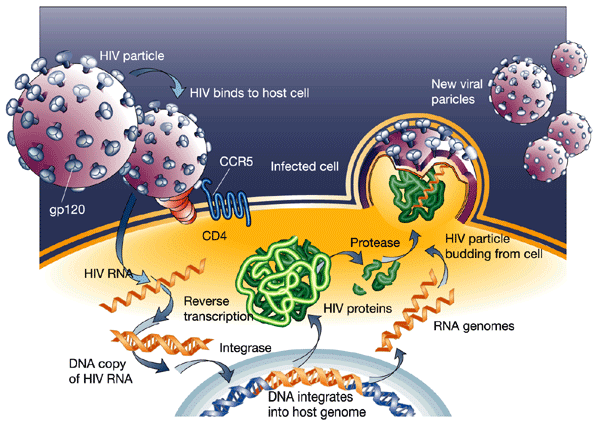
第四、病毒将自身RNA逆转录为cDNA与宿主的基因组整合到一起,建立持续性感染也是导致疫苗效果不佳的重要原因。
最后,大多数的HIV疫苗研究都集中在抗体介导的体液免疫上,这种免疫能中和游离在细胞外的HIV病毒颗粒。但是,为了控制HIV,诱导T细胞反应的细胞免疫也是值得重视的方面。
Kick-and-kill策略清除病毒储藏库
而对于消除病毒库的方法,目前也已提出了几种策略来重新激活潜在感染的CD4 + T细胞中的HIV表达。潜伏时间逆转剂(LRA)包括:表观遗传修饰剂,包括组蛋白脱乙酰基酶抑制剂(HDACi)和组蛋白甲基转移酶抑制剂,它们可在HIV LTR上诱导染色质重塑;蛋白激酶C(PKC)激动剂和NFκB途径的激活剂;溴结构域外末端(BET)基序抑制剂,可增强P-TEFb向HIV启动子的募集;细胞因子/趋化因子和Toll样受体(TLR)激动剂治愈艾滋病,它们激活T细胞中的免疫信号通路。
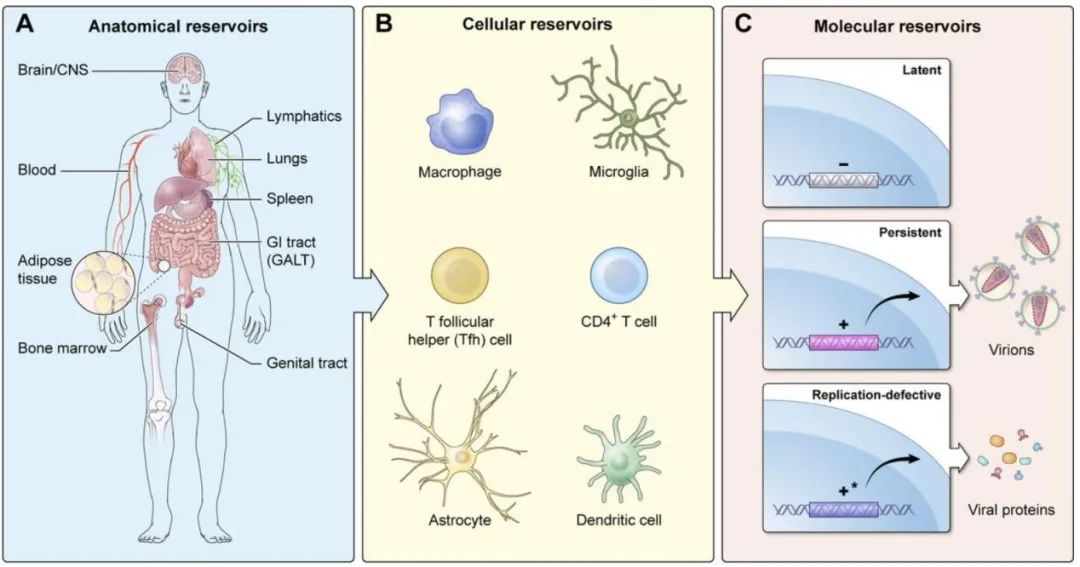
经过数十年的深入研究,艾滋病毒仍然是一种慢性感染,并且艾滋病毒感染者的人数逐年增加。基因疗法和免疫疗法的最新进展为艾滋病的治疗提供了新的希望。但仍需要进行一些临床前研究以完善这些方法,以确保将其输送至所有贮库并防止脱靶效应。
在进行临床试验之前,仍需要进一步的安全性研究和向所有组织贮库输送的方法。这些方法中的每一个的共同特征是由于血脑屏障和脑部感染的细胞类型不同于淋巴库而导致的中枢神经系统储库的挑战。尽管如此,一些免疫检查点分子抑制剂和其他抵抗免疫力衰竭/功能障碍的策略,特别是与新型抗逆转录病毒疗法、辅助免疫疗法、疫苗工作、病毒和/或宿主基因组的基因编辑以及新型抗Tat分子结合使用时,还可为感染HIV的患者提供更好的长期健康结果,并朝着实现完全治愈的目标迈进。
参考文献:
1、Henderson LJ, Reoma LB, Kovacs JA, Nath A. Advances toward CuringHIV-1 Infection in Tissue Reservoirs. J Virol. 2020;94(3):e00375-19. Published2020 Jan 17. doi:10.1128/JVI.00375-19
-END –



