原创 界弟 医学界
移植至今30个月,患者外周血、精液、脑脊液以及部分采样组织器官中均未能检出HIV,治疗团队就此结果正式宣布患者HIV治愈。
当地时间3月10日,THE LANCET HIV期刊刊出了一项轰动舆论的病例研究报告——来自英国伦敦的团队宣布全球第二例艾滋病患者成功治愈。该HIV感染者在发生霍奇金淋巴瘤之后进行了造血干细胞移植,治疗团队考虑到HIV感染的特殊性,选择了CCR5特殊变异的供体进行移植,移植至今30个月,患者外周血、精液、脑脊液以及部分采样组织器官中均未能检出HIV,治疗团队就此结果正式宣布患者HIV治愈。

THE LANCET HIV刊出的论文
这是一个好消息,但并不过于让人意外。2019年3月,“医学界”就已对这一例“伦敦病人”的进展进行过报道。当时,研究的主要负责人Gupta教授在Conference on Retroviruses and Opportunistic Infections(CROI,逆转录病毒和机会性感染会议)上汇报了这一病例治疗后18个月的情况,尽管彼时患者体内已经无法检出HIV,在报告中,Gupta教授依然谨慎的选择了使用“缓解”这个词来定义患者的状态。他当时对这一案例的评估是:“两年后我们才能更多的谈论‘治愈’。”

Gupta教授
一年刚过,治愈已到。可喜可贺。
目前宣布治愈的两人是什么情况?
第一例宣布HIV感染治愈者为著名的“柏林病人”Timothy Ray Brown,他于1995年被确诊感染HIV,于2008年在当年的CROI上被宣布治愈,2010年公开身份。2007年2月,Brown因白血病接受了造血干细胞移植,医生为他选择的供体与伦敦病人的供体同样是CCR5特殊变异者。移植后他的HIV感染情况逐渐缓解,达到无需抗逆转录病毒治疗,体内病毒载量也低至无法检出的程度。一年后他因白血病复发再次进行了来自同一供体的造血干细胞移植。
伦敦病人HIV的治愈与柏林病人在原理上基本相同,收治该患者的医疗小组同样给患者选择了CCR5特殊变异的造血干细胞供体,用于一箭双雕的治疗肿瘤和HIV。
截止2020年3月,伦敦病人已经停用抗逆转录病毒治疗30个月,本次刊出的结果显示患者CD4计数已上升到430个/ μL,占总T细胞的23.5%,CD4:CD8为0.86(正常值为1.5-2.5),尽管与健康人仍有差距,但患者并未发生机会性感染。移植结果显示,外周血T细胞嵌合体维持在99%。患者血浆DNA和脑脊液病毒载量测试结果显示,精度为1拷贝/mL的测试标准下,已检测不到HIV。精液病毒载量结果显示小于12拷贝/mL。具体情况如下图所示——
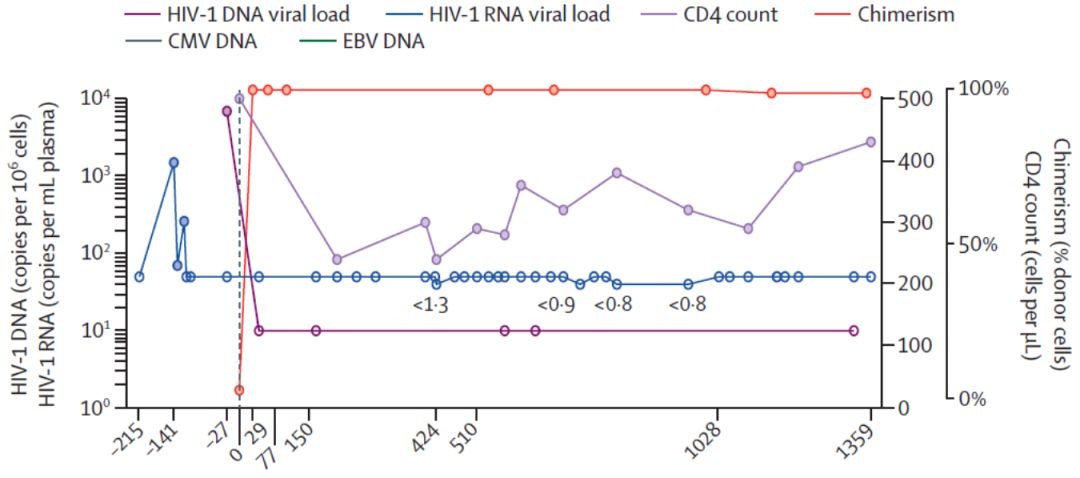
横坐标代表时间(天数),红色线代表外周血T细胞嵌合体比例,目前维持在99%,紫色线代表CD4细胞计数,紫红色线为检测得的HIV-1 DNA载量,蓝色线为HIV-1 RNA载量 ,两者都保持在极低水平。
另外,患者的EBV(人类疱疹病毒第四型)载量在移植后曾出现过反弹,后又自然恢复。CMV(巨噬细胞病毒)无明显临床反弹。
虽然不能说体内完全无HIV病毒了——论文显示伦敦病人淋巴结HIV病毒测试为弱阳性,但按照治愈标准,即在不需要抗病毒治疗的情况下HIV核酸检测为阴性且免疫系统不再呈现对HIV的获得性免疫反应,伦敦病人的医疗小组宣布患者治愈。
不过,这例患者和柏林患者一样,都在长期承受移植排异反应,2019年的CROI上甚至有来自澳大利亚的专家称这种移植排异反应可能帮助维持HIV病毒载量的低水平。由于存在造血干细胞移植本身带来的副作用和异体移植的风险性,目前这两例患者的成功还不能随便向无肿瘤的HIV感染者复制。
此外,这种移植方法并非次次成功,伦敦病人并不是该医疗小组的唯一病人,实际上他是队列研究中编号30的一例而已。Gupta教授此前在采访中已经表示,他经历过相同手段治疗的患者在移植后肿瘤复发死亡或者HIV载量下降后又上升,并指出这也是为什么柏林患者之后十年内未见其他成功治愈病例——不是医生不往那个方向努力,实在是成功率没那么高。
CCR5变异供体为什么能治疗HIV感染者
人类CD4细胞上有两种辅助受体能帮助HIV侵入细胞,一种就是CCR5,另一种是CXCR4,HIV需要通过和其中一种或者两种结合来最终实现入侵。
一般来说,感染早期HIV会通过CCR5进行入侵,但之后可能换走CXCR4通路或者两边都走。所以在用CCR5作为关键治疗HIV之前,许多研究者会首先确认感染者的HIV是亲CCR5的,而非其他情况。
对于亲CCR5的HIV病毒来说,如果感染对象的CCR5并不能让它利用,那么它也就不能侵入CD4细胞艾滋病患者,具备这样能力的人也就不会感染了。
柏林病人和伦敦病人的供体自带不让病毒利用入侵的CCR5变异,他们两人在接收造血干细胞移植之后形成的嵌合体也具备了这样的能力,因此HIV获得了治愈。
因为这些原理,近年来许多医生和研究者都在CCR5上动了不少脑筋,其中最为引人注目的就是使用基因编辑技术改造CCR5。
基因编辑CCR5到底有多大效果?
基因编辑和CCR5两个关键词串起来曾经闹出了巨大的争议,但并非所有的情况都存在重大的伦理问题。
比如去年解放军307医院联合北京大学等机构发表于NEJM的病例报告就是一个极好的利用基因编辑在HIV治疗方面的尝试——

在这一病例中艾滋病患者,我们中国的医生和研究者非常努力的尝试解决了一些过去在CRISPR-Cas9介导的基因治疗中存在的问题,且采取了用基因编辑的干细胞破坏患者细胞中的CCR5的思路,摧毁HIV的入侵通路,使HIV无路可走。
这项中国研究中的患者当时27岁,于2016年5月14日确诊AIDS,同年5月30日确诊急性淋巴细胞白血病(T细胞型)。确诊后立即采取抗逆转录病毒药治疗,最终使患者的HIV感染得到控制,1年后血清病毒RNA检测提示阴性(<40拷贝/mL)。
2017年患者与一名33岁男性供体配型成功,注意,这名供体的CCR5基因未突变——也就是这位供体并不能提供特殊的HIV治疗效果。
医疗小组确认了患者感染的HIV亲CCR5之后,决定人工创造突变,他们使用CRISPR-Cas9技术编辑了供体的CD34+细胞的CCR5。但是由于筛选细胞的效率存在技术问题,并非所有细胞都能被有效筛出,因此还存在未被编辑的CD34+细胞。
此后,医疗小组将编辑和没编辑的供体细胞都输入到了患者的体内。比较遗憾的是,患者在停止抗逆转录病毒治疗之后4周,HIV病毒载量出现了回升,此后恢复了抗逆转录病毒治疗。
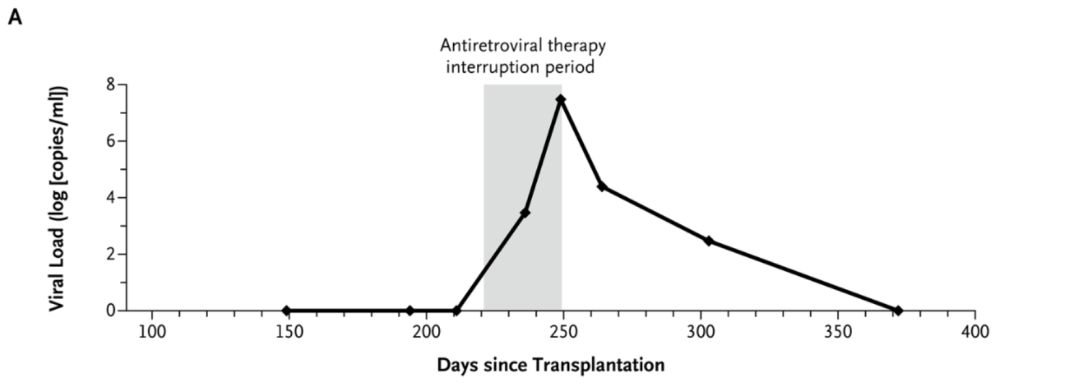
如图所示,横坐标为移植后的时间线,纵坐标为病毒载量,灰色柱状代表抗逆转录病毒暂停的阶段,在这一时期病毒载量出现了上升,此后患者恢复抗逆转录病毒治疗,病毒载量再次下降。
尽管病毒载量方面没有获得有效下降,但被编辑了CCR5的供体细胞并非没起作用。研究者发现,供体细胞在移植后达到完全嵌合,患者的急性淋巴细胞白血病在移植后19个月期间处于完全缓解,在此期间,含有经修饰CCR5基因的细胞持续存在,并且骨髓细胞中的CCR5破坏百分比为5.20%-8.28%,在多个造血细胞谱系中观察到CRISPR介导的CCR5敲除,这些都代表着基因编辑CCR5的细胞成功长期植入了患者体内。只是在这一病例中,应答效率还不足以治愈HIV。
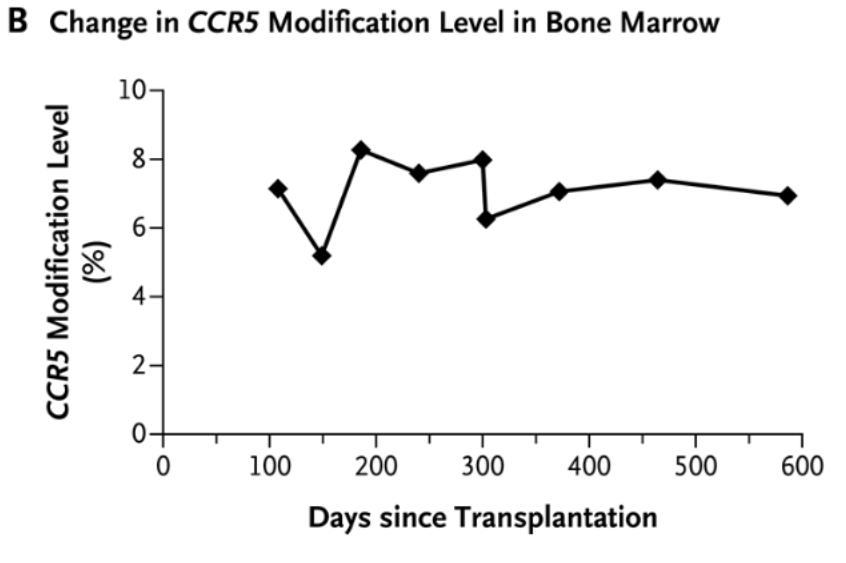
移植后骨髓细胞中基因编辑CCR5破坏水平,占5.20%-8.28%
尽管未能实现HIV的治愈,这项研究提示着这个治疗思路的可行性。在这次治疗中,研究者还解决了外源性DNA随机整合进入受体基因组诱发免疫应答或肿瘤形成的问题,与过去不同,本次Cas9核糖核蛋白是通过非病毒转染的方式引入,目的是避免引入外源性DNA,并且避免Cas9在靶细胞内长期存在,后者避免了引发脱靶插入缺失。

同时,研究者也提示目前CCR5靶向效率低,不仅影响治疗效果,也影响对脱靶的分析深度。最终这些研究者认为必须提高该CRISPR-Cas9系统的基因编辑效率,并改进这种情况下的移植方案。
此前,也有其他研究者做过HIV感染者自体细胞CCR5编辑再输回患者体内的试验,结果显示一定时间内一定程度上能帮助减少抗逆转录病毒药物的使用。
总的来说,目前成年人干细胞的编辑还存在着效率低,应答不足等等问题,各国的医生和研究者都在努力的想办法改进其中的技术问题。
而引发巨大争议的编辑人类胚胎细胞则有点不同,编辑胚胎细胞的思路在于通过人工手段制造出“天生”CCR5特殊变异个体,伦理学问题远大于采用编辑过的成人干细胞进行治疗,而且同样存在许多技术问题未被解决,不过这些问题也未能阻止一些他国科学家继续尝试编辑人类胚胎就是了……
参考文献
Lei Xu,Hongkui Deng,Hu Chen et al CRISPR-Edited Stem Cells in a Patient with HIV and Acute Lymphocytic Leukemia N Engl J Med 2019; 381:1240-1247 DOI: 10.1056/NEJMoa1817426
Jon Cohen Russian geneticist answers challenges to his plan to make gene-edited babies
Jon Cohen Has a second person with HIV been cured?
Timothy Ray BrownI Am the Berlin Patient: A Personal Reflection AIDS Res Hum Retroviruses. 2015 Jan 1; 31(1): 2–3.
Ravindra Kumar Gupta, Dimitra Peppa, Javier Martinez-Picado, Eduardo Olavarria et al Evidence for HIV-1 cure after CCR5Δ32/Δ32 allogeneic haemopoietic stem-cell transplantation 30 months post analytical treatment interruption: a case report Lancet HIV 2020 Published Online March 10, 2020



