
中国艾滋疫情究竟如何了?
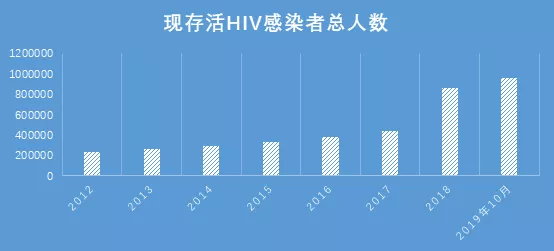
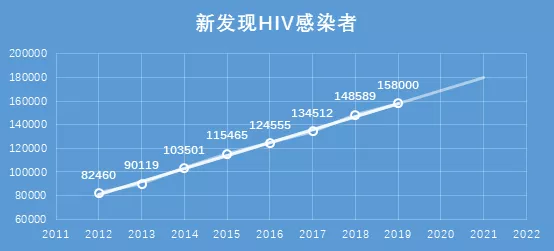
在2012年12月,全国报告存活HIV感染者共24万人,截至 2019 年 10 月底,全国报告存活感染者 95.8 万,相较于2012年已然翻了两番。而2019年全年新发现感染者(根据2019年1-10月疫情数据预测),相较于2012年,也将翻一番。HIV疫情扩散增速平稳,新发现HIV感染者以每年1万人的加速度加速增长。
HIV 感染者人数在全国各地存在很大的地区差异,四川、云南、新疆、广西、广东及河南是发现 HIV 感染者数量最多的五个省份。
近年来全国艾滋病发病数、发病率快速增长,新发疫情水平在总体上呈现出 “南高、北低、西高、东低”空间分布格局和“西快、东慢”异速增长特征,但是在各热点省区的疫情向周边省份扩散较明显,在西南地区形成了以广西、云南、贵州为中心的高发连片区,而西北以新疆为中心,向周边疫情省份不断渗透[1]。
随着经济水平的进一步发展,基础设施建设进一步完善,人口流动更为便捷,未来新发感染的省际差异也可能逐步缩小。
传播途径变化暗藏危机
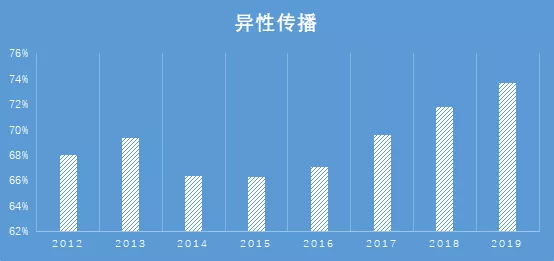
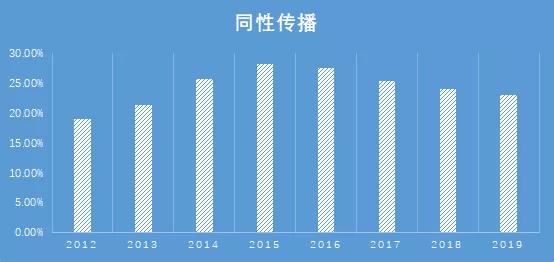
2019 年1-10月新报告感染者中,异性性传播占 73.7%,男性同性性传播占23.0%。经异性性传播途径感染的病例所占构成比,相较于2008年的8.7%,上升了8倍。在2012至2019几年间,异性新发感染占比早期出现了一个小幅度的下降,随后快速增高,这个小幅度的下降与同性传播猛增趋势相符。HIV感染已有明显的从所谓的重点人群向非重点人群扩散的态势。

在全方面的艾防教育狂轰滥炸下,所谓的两大重点人群男同性恋者与女性性工作者安全意识已经有了较为明显的提高,在一项针对男同性恋人群安全套使用率的调查中,最近一次与性伴发生性行为安全套使用率已从2012年的41%上升至了75%。
但是值得注意的是,男同性人群因其群体内本身HIV高流行率,单次性行为高传播风险,依旧以约5%的总人口贡献了23%的新发感染占比。
女性性工作者中,HIV感染率在过去 5年中已下降至 0.2%左右[2]。但各地区的性工作者之间的HIV感染率差异很大,在云南省中越边境地区的性工作者HIV感染率约2.74%。而在东部地区,女性性工作者安全套使用率大多超过90%艾滋病,想在众多性工作者中找到一个携带HIV的女性,难度极高,甚至HIV感染率低于当地一般人群,以上海和江苏省为例,两地固定场所商业性行为从业者HIV感染率[3-6]。
所谓的“高危人群”正在逐渐变得安全,而常常被认为是安全的人群,正在面临着高危。中学生、大学生、老人甚至是一段恋爱关系中的对象,均可能是潜在的HIV感染人群。
原发耐药,养蛊与加速
“来拿药?本子给我,拿好,记得每天定时吃。”
这样的场景在定点医院每天都在发生,替诺福韦、拉米夫定、依非韦伦,大部分感染者机械的领着同样的药,机械的吃着同样的药,医生机械的发着同样的药。这种状况持续了十余年。
同一个组合,对一个极易突变的RNA病毒长时间应用,可以预见的后果就是,耐药发生,耐药株进化、传播。
传播性耐药(TDR)指的是在从未接触过抗病毒药物的病人检测到的耐药,也就是被耐药病毒株感染,是原发性耐药的主要原因。
我国2004 - 2005年一项全国范围原发性耐药调查结果显示[7],总体传播性耐药率为3.8% 。2008-2009年在我国五个省七个地区进行了传播性耐药调查,除北京外其他地区传播性耐药率均
但是,近几年来的越来越多的调查发现,耐药突变毒株流行率与日俱增,全国范围内HIV病毒传播性耐药率在2015年已达到4.7%,已接近WHO提出的5%中度耐药警戒线,在2018年,中国很多地区HIV耐药已经超过了WHO的耐药红线,特别是中南及西南地区整体耐药率已经远超过该警戒线[9-11]。
北京、天津、河北、河南、广西传播性耐药均高于5%。而浙江省、上海市、四川等地传播性耐药占比已超过了10%。传播性耐药疫情短短几年在我国呈现出井喷的态势[12-19]。
上药前大多感染者也未进行耐药筛查,致使很多潜在、低度、中度耐药突变在药物的筛选下快速迭代,全面抗药,而免费药物组合单一,也使得耐药株可以在HIV感染者群体中相互传播。在鸡尾酒疗法中,即便只有一组药出现高度耐药,剩下两种在时间的筛选下,也有较大概率发生高度耐药。
在耐药出现后,因为我国免费病毒载量检测一年仅一次,部分地区还存在着标本长时间冻存送检的情况(最长有抽血到检测相隔超过半年的情况发生),其检测结果的精度可能也有所折扣。
抑制传播耐药发生,唯一可行方法就是在用药前进行耐药基因检测,个体化定制用药方案,避免应用存在潜在耐药活低度耐药的药物,避免“养蛊”发生。在用药后病毒载量得到抑制免疫状况稳定前,较频繁进行高精度病毒载量检测。
替拉依、齐拉耐、替拉克,单一且统一的免费药组合配合不到位的检测,耐药毒株的温床已然铺好。如果将个体化治疗纳入免费治疗中,对国家财政来说也是一笔巨大的负担。耐药问题目前难以解决,这是可能中国艾滋疫情最大的潜在隐患。
性教育,还在原地踏步?
去年我国高校有3077例学生感染,81.8%为同性性传播,安全套使用率不足40%。而据麦可思研究院公布的“2018年在校大学生性知识教育调查”,55%的受访学生表示“不会刻意关注”艾滋病防治知识,超九成学生认为有必要加强性教育。
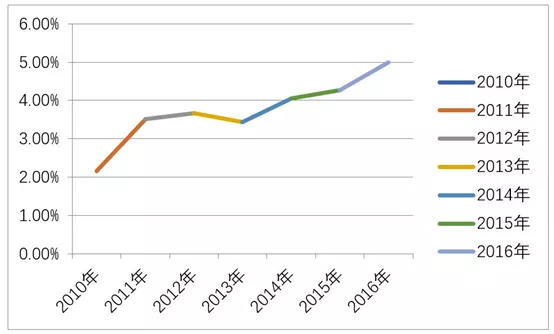
(2010-2016年青年学生病例数占当年病例报告总数百分比)
2017年秋,中国性病艾滋病防治协会等单位对8771名青少年开展了一项基于互联网的网约性行为调查,调查对象中男女各占44.90%和55.10%。

调查显示,男性和女性网约性行为发生比例分别为63.89%和36.11%。男性的网约性行为主要发生在20岁以上,20~24岁和大于24岁两个年龄组均超过44%;15~19岁占9.18%,小于等于14岁占1.73%。
而女性该行为主要集中在20~24岁,占60.71%;15~19岁占16.47%;小于等于14岁占1.88%。整体上女性发生网约性行为年龄稍早于男性。我国大部分20~24岁的青少年正处于大学时期,而15~19岁及小于等于14岁的人群则多为高中生和刚进入青春期的中小学生。
加强性教育喊了这么多年,但是不幸的是,部分针对中小学生的性教育课程因“尺度大”屡屡被举报。可能家长都没想到,在觉得性教育尺度大的同时,部分初中、高中的学生可能在外已经“炮火连天”。
中国艾滋病疫情不容乐观,在目前看来无论是从性教育,还是对感染者治疗方面都存在较大的隐患。疫情扩大的态势在意料之内,不出意外,疫情加速扩散的态势在此种环境下将继续保持数年甚至是数十年。
传播途径与HIV几乎一致的乙肝最终感染了上亿的中国人,但愿艾滋不要走上乙肝的老路。
[1]丁启燕, 杨振, 周晴雨. 中国艾滋病疫情分布变化与人口流动性研究[J]. 热带地理, 2017(4).
[2]中国疾病预防控制中心性病艾滋病预防控制中心.全国艾滋病性别丙肝综合防治数据信息年报(2018)
[3]唐政, 倪莹青, 王震宇, et al. 2010-2011年上海市长宁区艾滋病哨点监测结果分析[J]. 中国初级卫生保健, 2013, 27(3):48-50.
[4]任福琳, 赵红芳, 王燕. 高档娱乐城女性性服务者特征及艾滋病相关知识、行为调查[J]. 江苏卫生保健, 2013, 15(2):45-46.
[5]陈盼盼, 金樱枝, 付文捷, et al. 浦东新区低中档暗娼HIV和梅毒感染情况及安全套使用影响因素[J]. 中国艾滋病性病, 2017(06):66-69.
[6]王国利, 吴瑞斌, 朱亚刚, et al. 苏州市娱乐场所女性性工作者高危行为干预效果分析[J]. 江苏预防医学, 2014(2).
[7]LiaoL, XingH, ShangH, etal. Theprevalence of transmitted antiretroviral drugresistance in treatment-naïve HIV0-infecteted in-dividuals in China [J]. JAcquir Immune Defic Syndr , 2010, 53 (Suppl 1): S10-S14.
[8] Liao L , Xing H , Dong Y , et al. Surveys of Transmitted HIV Drug Resistance in 7 Geographic Regions in China, 2008-2009[J]. Clinical Infectious Diseases, 2012, 54(suppl 4):S320-S323.
[9]邓仁麂 , 何静 , 刘奉凤 , et al. 重庆市新确证HIV-1感染者传播性耐药突变研究[J]. 第三军医大学学报, 2018.
[10]周全华, 凌华, 邢辉, et al. 重庆市HIV-1耐药警戒线调查[J]. 现代预防医学, 2013, 40(20):3860-3862.
[11]董敖渤,赵帅,邢辉.艾滋病耐药毒株的流行传播及进化研究[J].中国艾滋病性病,2019,25(02):197-200.
[12] SONG YX, XIN RL, LI ZC, et al. Prevalence of transmitted drug resistance among HIV-1 treatment-naivepatients in Beijing. Epidemiol Infect,2018,146(3):339–344.
[13]郑敏娜,宁铁林,周宁,等.天津市 2014-2017 年男男性行为人群艾滋病病毒感染者原发性耐药分析.中华流行病学杂志,2018,39(5):619–624.
[14] WANG X, LIU X, LI F, et al. Epidemiological surveillance of HIV-1 transmitted drug resistance among newly diagnosed individuals in Shijiazhuang, northern China, 2014-2015. PLoS One,2018,13(6):e0198005.
[15]孙定勇,刘佳,许巍,等.河南省 302 例新确证 HIV 感染者和艾滋病患者中 HIV 毒株基因亚型分布和原发耐药研究.中华预防医学杂志,2016,50(8):733–737.
[16]XU Y, PENG X, PENG X, et al. Characterization of HIV-1 subtypes and transmitted drug resistance among treatment-naive HIV-infected individuals in Zhejiang, China, 2014-2017. Arch Virol,2018,163(8):2233–2237
[17]WANG Z, ZHANG M, ZHANG R, et al. Diversity of HIV-1 genotypes and high prevalence of pretreatment drug resistance in newly diagnosed HIV-infected patients in Shanghai, China. BMC Infect Dis,2019,19(1):313.
[18]CHEN R, LIANG B, WEN B, et al. No difference in prevalence of transmitted drug resistance between injection drug users and non-injection drug users: a cross-sectional study among antiretroviral treatment-naïveHIV patients. Intervirology艾滋病,2018,61(6):281–291.
[19]董敖渤,肖琳,梁姝,等.凉山彝族自治州 HIV/AIDS 抗病毒治疗前 HIV-1 耐药情况及其影响因素分析.中华流行病学杂志,2019,40(6):648–653.



