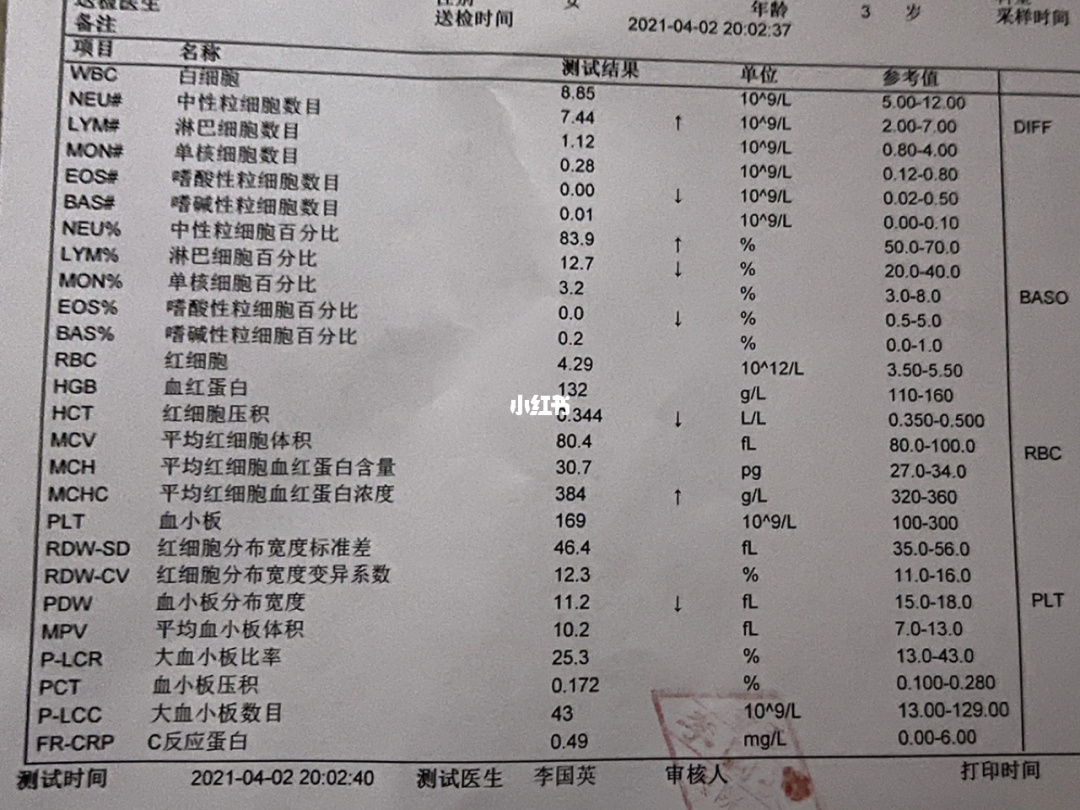
1病例资料
患者男性,56岁。主因发热并伴有寒战、盗汗、肌痛和厌食2周就诊。患者自述服用对乙酰氨基酚 1g/8h对于发热有部分缓解。现病史包括高血压和2型糖尿病,口服药物控制良好。患者居住在农村地区,近期无外地旅行史。家族史无特殊。
入院体检,心率108次/min,其余均正常。实验室检查显示C反应蛋白(CRP)30.36mg/dL,无白细胞增多,血沉(ESR)升高,为101mm/h。肝功能检查提示胆红素水平正常的急性肝损伤(AST 223U/L, ALT 224U/L, GGT 737U/L, FA 303.01U/L, 总胆红素1.09mg/dL),并伴有国际标准化比值(INR)自发性升高,为1.4以及低渗性低钠血症(Na 130mmol/L)。
HIV、HAV、HBV、HCV、巨细胞病毒和SARS-CoV-2血清学检查均为阴性。经聚合酶连反应(PCR)检测证实EB病毒(EBV)(IgM 和 IgG VCA)为假阳性。血液和尿液培养均为阴性。
胸片显示弥漫性肺间质浸润,胸腹CT检查显示弥漫性支气管增厚以及肝脾肿大并伴有轻度胸膜和腹膜浆膜炎。
患者随后转入内科进行进一步的诊治,开始经验性静脉应用头孢曲松治疗但无应答,患者持续疲乏和每日高热(最高体温39.1℃)。
经过血清学和/或尿抗原试验排除了多种感染性原因,包括肺炎支原体、嗜肺军团菌、立克次体、布鲁氏菌、钩端螺旋体、巴尔通体、伯氏疏螺旋体、土拉热杆菌、埃利希菌和肺炎衣原体。支气管肺泡灌洗和干扰素-γ释放试验中结核分枝杆菌PCR检测也为阴性。由于Ⅰ相IgM低滴度和Ⅱ相IgG阴性,贝氏柯克斯体血清学检查无定论。经胸超声心动图检查未发现心脏赘生物。

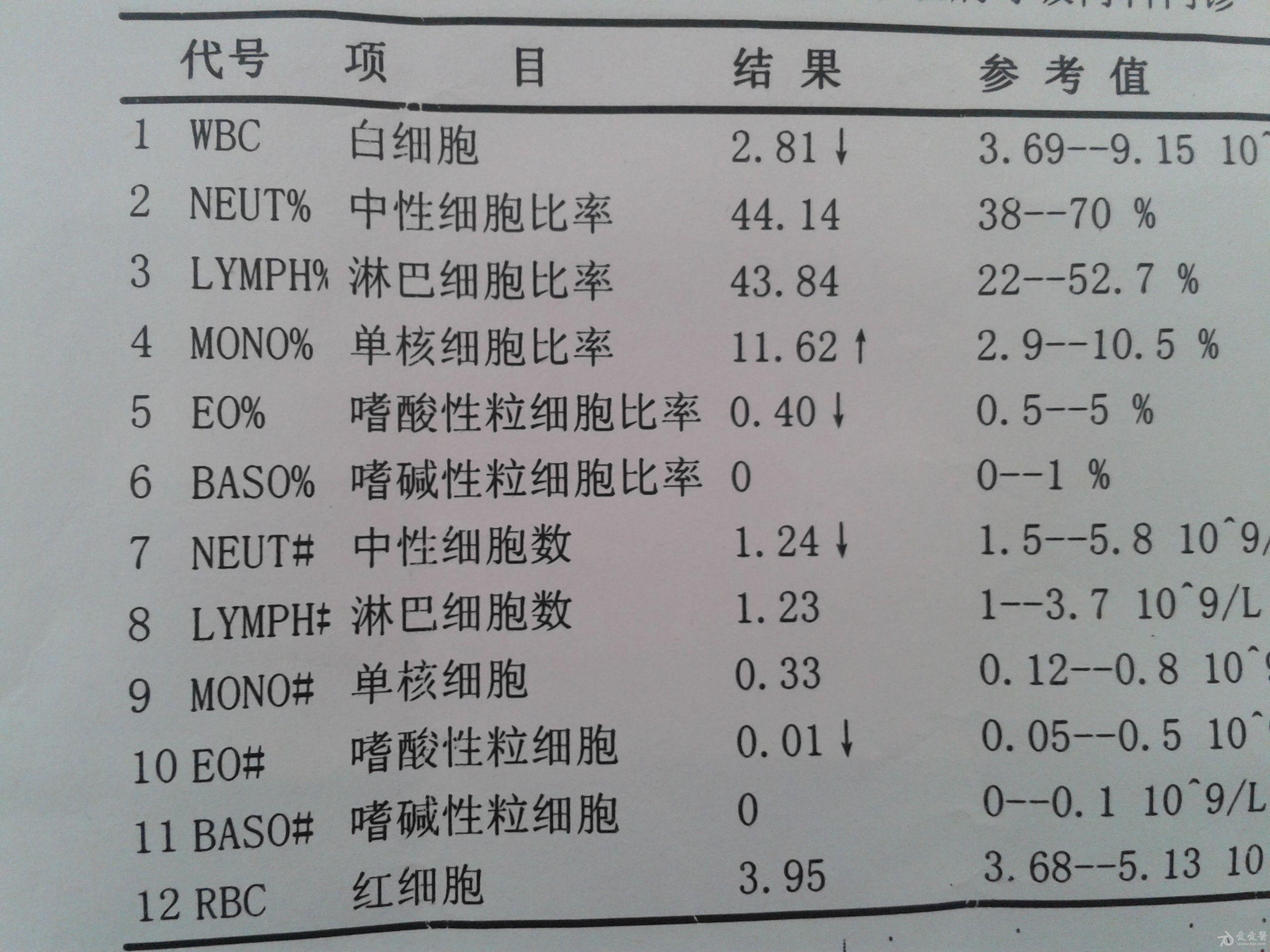
进一步血液学检查显示艾滋病自述,抗核抗体(ANA)滴度为1/160并带有细小斑点,抗双链DNA低滴度,补体C4低水平为3.8mg/dL,C3水平正常艾滋病自述,血清血管紧张素转换酶(ACE)水平高表达,为163.72U/L,以及铁蛋白水平升高,为7,662ng/mL。无其他与狼疮、自身免疫性肝炎或血管炎相关的自身阳性抗体。胸部CT检查排除肺门或纵膈淋巴结肿大。前列腺特异性抗原和甲胎蛋白水平均正常。
骨髓培养无菌生长。骨髓象和活检提示10%的多克隆CD138+浆细胞伴弥漫性肉芽肿和中心脂质空泡。
临床高度怀疑人畜共患病,开始应用强力霉素治疗。患者病情发展为高钙血症(血钙11.5mg/dL)和持续性炎症伴血沉和铁蛋白 (3,240ng/mL)水平升高。应用地塞米松8mg/d,持续3d,然后缓慢减量2周,血钙水平恢复正常,炎症参数降低,ACE水平降为84.95U/L。

重复检测贝氏柯克斯体,通过Ⅱ相IgG 3,200,Ⅱ相 IgM 50以及Ⅰ相IgM 100诊断为急性Q热。患者接受强力霉素维持治疗14d,病情逐渐改善,炎症参数、ACE水平以及肝功能恢复正常。3个月后,患者症状完全消失,经 18-F-FDG PET-CT扫描检查排除潜在的血管和心脏受累。
2分析讨论
Q热是一种由贝氏柯克斯体(Coxiella burnetii,Cb)引起的一种人畜共患的发热性疾病。由于Q热临床表现多变且具有非特异性,诊断通常很困难。对具有该病危险因素(如与农场动物接触,居住在农村地区、前往疾病流行地区等),以及Q热感染的症状和体征的患者,应考虑Q热的诊断。
由于Cb是严格的细胞内生长病原体,血培养均为阴性,故病原学诊断依赖核酸和血清学检测。Q热急性期患者一般仅产生Ⅱ相抗体,发热数周后才出现低效价的Ⅰ相抗体。通常情况下,Ⅱ相IgG>200和/或IgM >50认为对于原发性Q热感染的诊断具有重要意义。
急性Q热患者通常会出现自身免疫的生物标志物。在急性Q热期间已检测到抗平滑肌抗体、抗中性粒细胞胞浆抗体、抗核抗体和抗磷脂抗体。本例患者出现抗核抗体阳性和anti-dsDNA低滴度,解释为附带现象。感染治疗后未出现狼疮的系统性症状。
骨髓检查应作为评估不明原因发热的一部分,肉芽肿常见于结核病、梅毒感染、组织胞浆菌病和布鲁氏菌病。与Q热相关的骨髓病变报道很少,Q热患者的组织切片中可见不同类型的肉芽肿。
急性Q热的预后一般良好,最佳治疗方案是强力霉素 100 mg,2次/d,共14 d。预防Q热的发生与暴发流行特别需要加强家畜的管控,防止和减少家畜的贝氏柯克斯体感染,阻止感染家畜排泄物对环境污染。特异性预防措施包括优先考虑对于经常暴露于贝氏柯克斯体的高风险人群接种人用Q热疫苗。
参考资料:
1.Carvalho J, Pereira S, Boavida L, et al. (October 14, 2021) Bone Marrow Granulomatosis in Acute Q Fever. Cureus 13(10): e18782.
2.熊小路,焦俊,温博海.加强我国Q热的防控[J].寄生虫与医学昆虫学报.2020,27(4):258-263.



