本公众号由云南省防治艾滋病局云南防艾”进行关注。
2023年第12届国际艾滋病学协会(IAS)HIV科学会议于在2023年7月23日至26日在澳大利亚布里斯班和线上共同举行,会议由国际艾滋病学协会(IAS)主办。在2023年7月22日举办的会前会“2023 HIV Cure & Immunotherapy Forum”上,专家学者们针对HIV功能性治愈及免疫治疗进行了深入研讨。
会议内容包含了来自多个领域的研究成果,涵盖了中和抗体联合治疗、ART停药后治疗研究、疫苗及免疫治疗、基因治疗等多方面研究成果。来自全球多国家的科学家、临床医生、公共卫生专家和社区领导人共聚一堂,探讨前沿热点。
以下为小编为您整理的部分前沿研究成果:
01
R5 breakthrough after a successful CCR5-delta 32 stem cell transplant (by Eli Boritz form National Institutes of Health, United States)
来自美国national Institutes of health的Eli Boritz分享了他们团队通过干细胞移植治愈HIV失败的病例报道。这可能是全球首例报道。
67岁的芝加哥患者于2008年诊断为HIV,2019年5q-MDS转化为AML,并且在经历二线治疗后有所缓解。于是考虑进行干细胞移植,选择了CCR5Δ32/Δ32,10/10 HLA-matched的供体。而患者的HIV 100%为R5-tropic。
在接受成功的干细胞移植90天后,患者的HIV血浆病载基本检测不到。在患者干细胞移植成功后持续ART治疗至420天后开始ATI观察期。
患者在进入ATI阶段3天后,便观察到病毒有反弹艾滋病治愈,第8及第9周后依旧有病载被检测到。
作者对不同时期样本进行SGS测序,发现反弹病毒在基因上彼此相似,但并不完全相同。
那么,是什么导致的病毒反弹呢?
作者通过流式检测干细胞移植后PBMC的免疫学特征,发现依旧有少量CCR5+ CD4+ T细胞存在,而这可能是导致病毒反弹的原因。
作者同时检测了干细胞移植后的HIV的特异性结合抗体水平,发现在干细胞移植后下降,病毒反弹后略有增强。还同时检测了gag特异性的CD4\CD8+ T细胞反应水平,发现无论是在病毒反弹之前还是反弹之后,都没有检测到HIV特异性的T细胞反应。这次失败也值得我们更加深入的学习,让HIV治愈早日实现。
02
Potent, HIV-specific latency reversal through CRISPR activation delivered by lipid nanoparticles exhibiting a high efficiency of transfecting resting CD4+ T cells with minimal toxicity(by Paula M Cevaa from Peter Doherty Institute, Australia)
HIV储存库是治愈HIV的最大障碍。传统的“shock and kill”思路试图通过潜伏逆转剂(latency-reversing agent, LRA)重新激活潜伏状态的HIV基因组进行转录,并借由ART或细胞毒性CD8+ T细胞等杀伤重激活的潜伏细胞。
过去十几年,科学家已经发现了大量的LRA候选药物,但是没有一项基于LRA的临床试验能有效地降低储存库规模。

传统潜伏逆转剂LRA失败的原因(图1)
①缺乏强有力地诱导HIV基因组启动转录延伸和剪接的能力
②非特异性激活导致广泛的细胞毒性
Cevaa团队为解决上述问题,提出通过sgRNA来靶向激活HIV LTR区域,特异性地启动HIV基因组转录艾滋病治愈,并通过脂质体纳米颗粒(LNP)作为核苷酸的转运方法,以减少细胞毒性(图2)。然而,传统的LNP对静息状态的CD4 T细胞的转染效率低下(图3)。Cevaa团队改造了传统LNP(方法未阐明),改造后的LNP对静息CD4+ T细胞的转染效率极高(图4),并且对T细胞有更强的靶向性(图5)。改造后的CRISPRa-LNPs能有效激活HIV基因组转录(图6),并且不会激活CD4+ T细胞,细胞毒性极低(图7)。
图2:传统LNP策略
图3:传统LNP转染静息CD4 T细胞效率低下

图4:改造后的LNP对静息CD4 T细胞转染效率极高
图5:改造后LNP对T细胞靶向性更强(相比于PBMC样本)
图6:改造后的CRISPRa-LNPs有效激活HIV基因组转录
图7:改造后的CRISPRa-LNPs不会激活CD4 T细胞并且细胞毒性极低
图8:总结
03
Favourable tranomic signature of HIV-specific CD8+T cells in response to sigle anti-PD1 dose in people with HIV on ART and cancer (by Jan Schroeder, Peter Doherty Institute, Australia)
这是一项来自墨尔本“Peter Doherty”研究所的“Jan Schroeder”进行的研究汇报,针对8名接受抗PD-1治疗的HIV合并肿瘤患者进行了样本分析。研究人员观察了接受不同剂量的PD-1治疗的患者在不同时间点T细胞功能反应的变化。在首次注射抗PD-1抗体后,HIV的CD8+ T细胞亚群发生变化,TEX细胞迅速增多而TTM亚群减少。此外,还发现TCM转录组也出现了显著改变。
随后,研究人员将这些参与者分为T细胞功能改善组和功能未改善组,并观察了HIV RNA和HIV DNA的变化情况。然而,遗憾的是,作者并未发现HIV储存库大小和抗PD-1反应之间的关联。这一发现为进一步理解抗PD-1治疗在HIV合并肿瘤治疗中的潜在作用提供了有价值的线索。
本次大会是一次跨国际的交流盛会,与会者们深入探讨了这些成果的科学意义和临床应用潜力,为开展更加有效的HIV治疗提供了新的思路。这次会前会为各界专家提供了一个宝贵的平台,促进了科学研究成果的分享与交流,同时也凝聚了各国在防治HIV功能性治愈及免疫治疗方面的共识。
相信这些前沿研究成果的积极影响将持续扩散,推动艾滋病学科的发展,为实现全球的HIV控制目标贡献力量。
另外,后续将持续更新IAS会议最新内容,敬请期待!
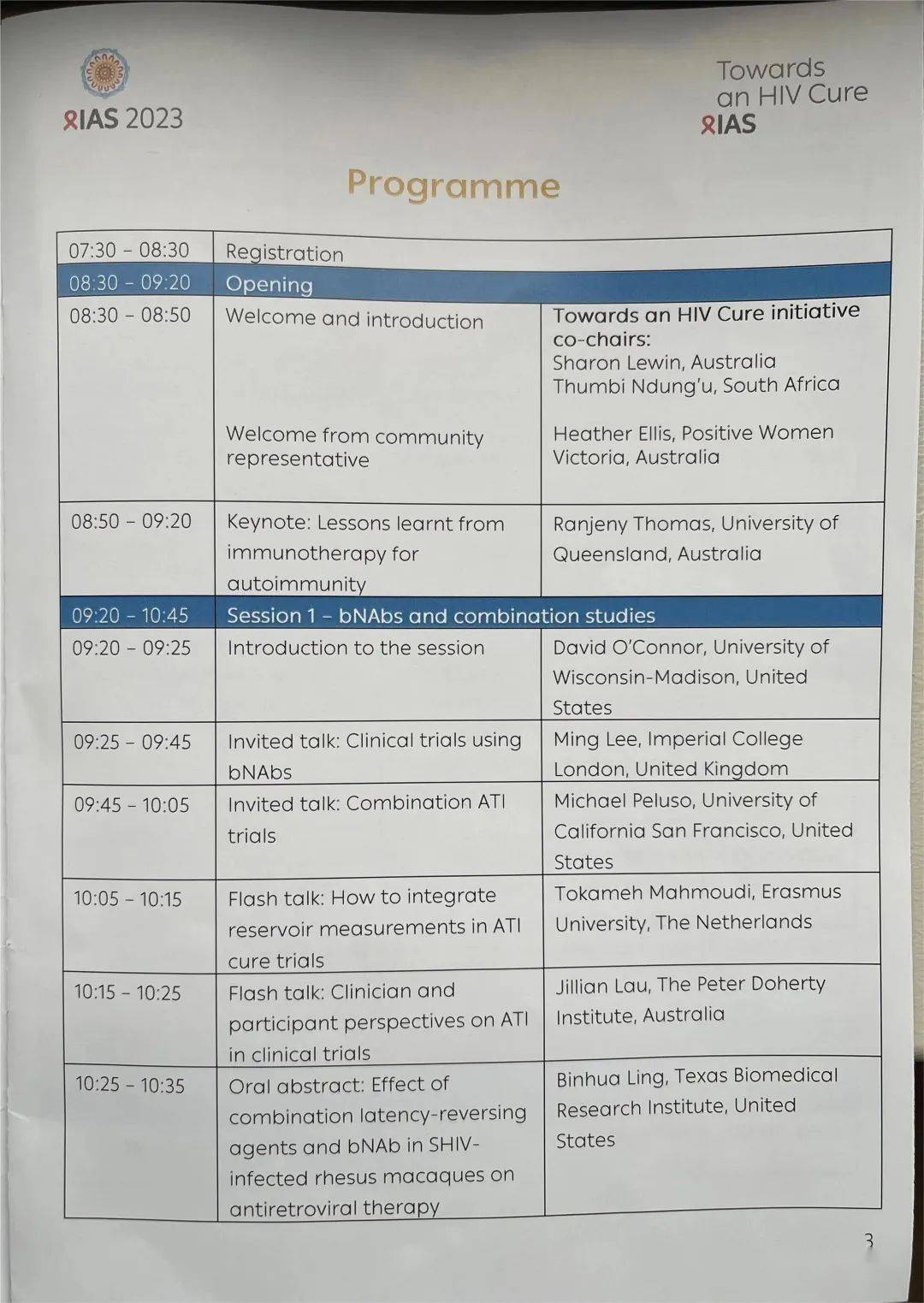
(附) 此次会前会全部内容:
01
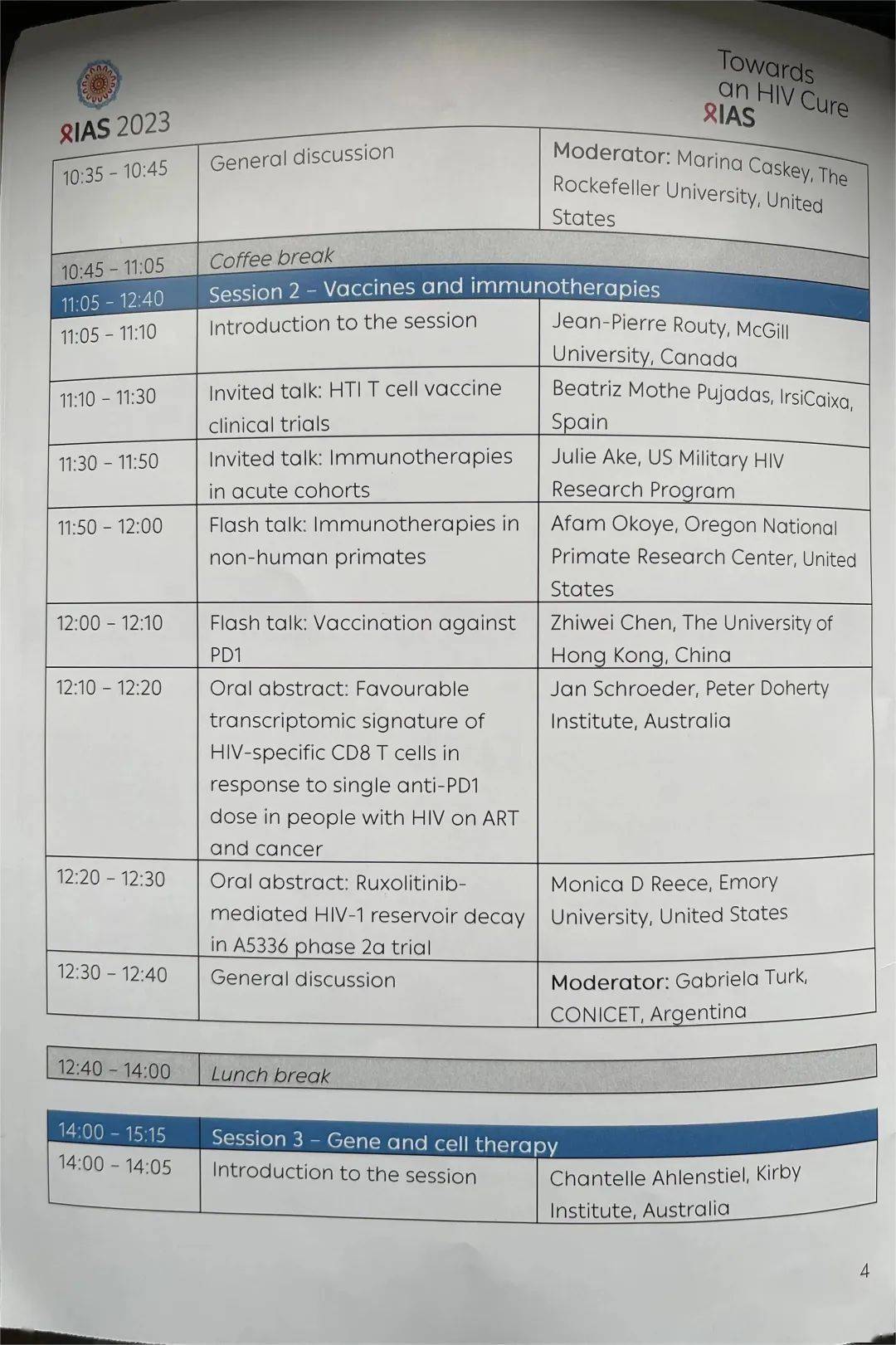
02
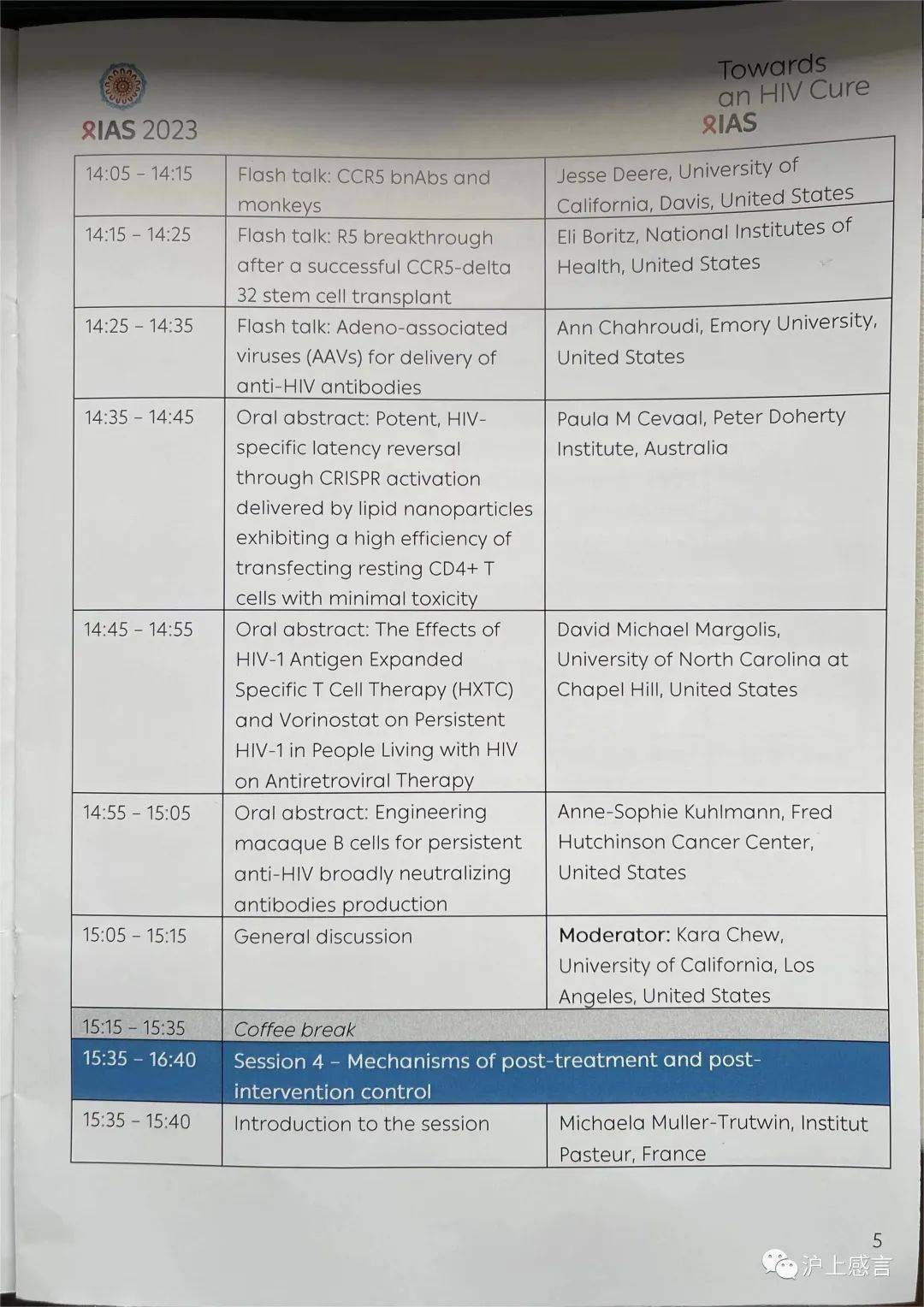
03
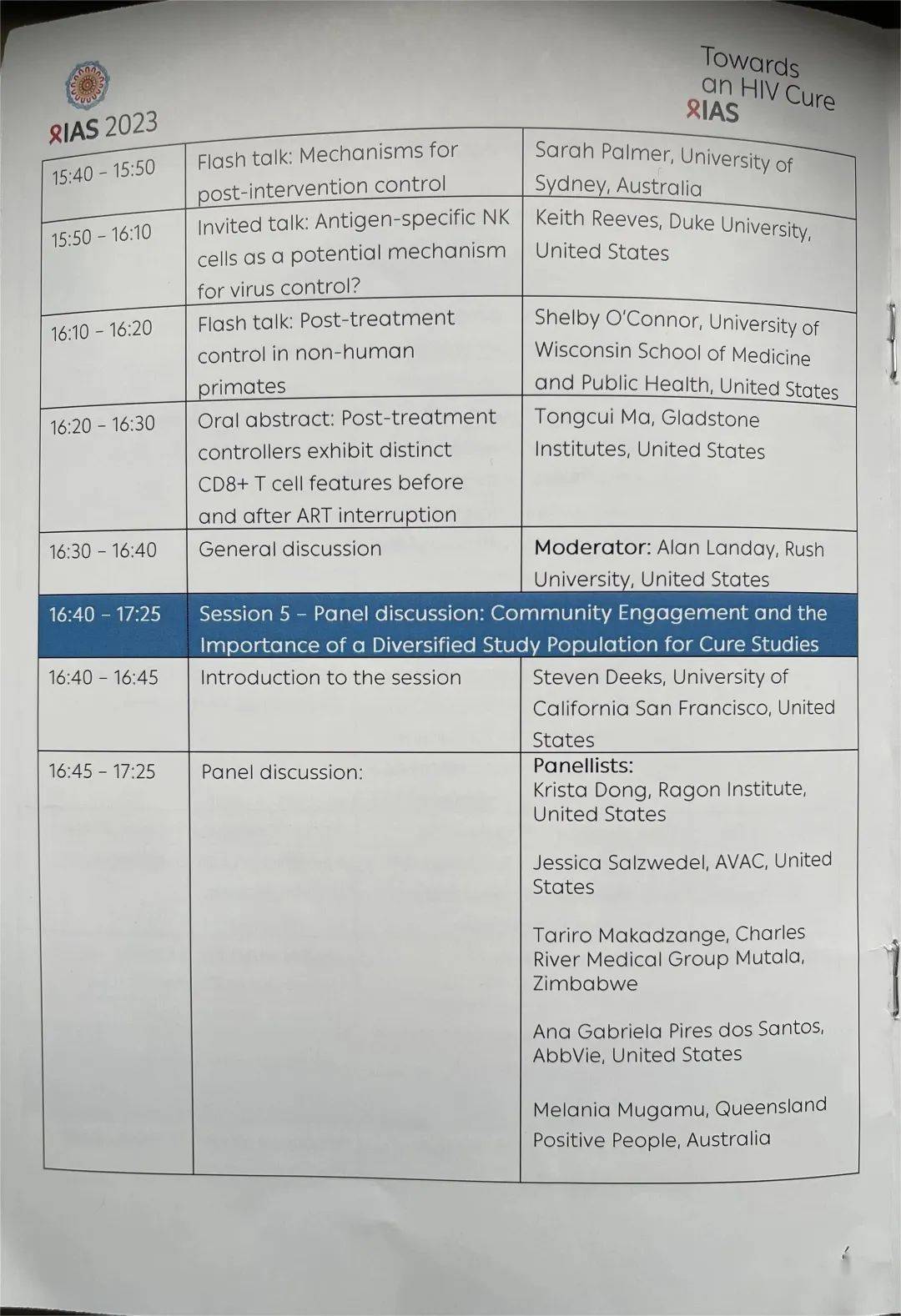
04
05