肠道含有全身约80%的淋巴细胞,其中约40%为CD4+ T细胞。这些CD4+ T细胞高表达HIV共受体CCR5,并且与肠腔中大量抗原长期接触而处于免疫活化状态,使肠道成为HIV感染时的主要靶器官和病毒库。HIV感染后肠道上皮细胞再生能力下降,粘膜通透性增加艾滋病急性期,导致微生物及其产物通过粘膜屏障易位进入全身血液循环导致持续免疫活化,加速疾病进展。ART治疗后肠道粘膜免疫重建效率低,导致肠粘膜屏障损伤、微生物易位和免疫活化的持续存在。
目前研究认为CD4+ T细胞的丢失及炎症反应是诱导肠道粘膜屏障完整性损伤的主要因素。但是SIV感染急性期肠道上皮屏障紧密连接蛋白表达下调要早于Th17细胞丢失和中性粒细胞浸润,并且参与上皮维护、再生和修复的蛋白改变早于免疫反应相关蛋白变化,提示肠道粘膜免疫反应可能不是上皮结构损伤的起始因素。因此,研究HIV/SIV感染早期上皮屏障损伤原因是实现HIV功能性治愈的重要策略。
中国科学院昆明动物研究所研究员郑永唐团队利用SIVmac239感染猕猴艾滋病模型,研究发现了艾滋病急性期肠粘膜屏障损伤的新机制:SIVmac239感染14天时猕猴空肠上皮紧密连接蛋白表达显著下调,肠型脂肪酸结合蛋白水平显著升高,上皮细胞衰老、凋亡增加。随后,为了研究感染急性期肠道上皮屏障损伤的具体机制,研究人员对SIV感染前后的空肠组织样本进行转录组测序分析。结果显示,病毒感染前后空肠组织的差异表达基因主要富集在氧化还原、氧化磷酸化相关的信号通路。进一步体内实验发现,空肠上皮细胞及其周围免疫细胞特别是巨噬细胞产生活性氧水平均显著增加,导致空肠组织氧化应激,上皮细胞DNA氧化损伤增加。体外实验发现,免疫细胞通过ROS依赖的机制在上皮屏障损伤中起重要作用,并且抗氧化剂能够抑制HIV-1 Tat蛋白诱导的HT-29细胞DNA氧化损伤和凋亡。此外,研究还发现SIV感染14天时,猕猴肠道和血浆中的炎症因子水平与感染前相比整体无显著变化,且病毒感染前后空肠组织的差异表达基因未富集到炎症相关信号通路。综上所述,活性氧可能是起始SIVmac239感染急性期猕猴空肠粘膜屏障损伤的主要原因。
该研究成果以Jejunal Epithelial Barrier Disruption Triggered by Reactive Oxygen Species in Early SIV Infected Rhesus Macaques为题艾滋病急性期,在线发表在Free Radical Biology and Medicine上。研究工作得到国家自然科学基金等的资助。
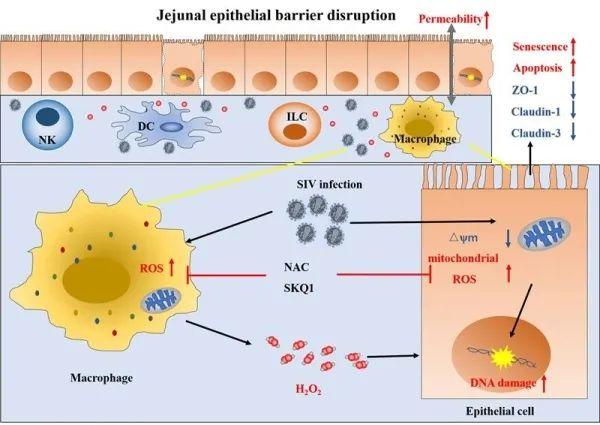
SIVmac239病毒感染急性期猕猴空肠上皮屏障损伤机制示意图



