2020年诺贝尔医学奖颁给了对丙肝治疗有重大贡献的3位科学家。丙肝病毒在体内能够彻底的清除也让人类对艾滋病病毒(HIV)的治疗有了更多的期盼。那么攻克艾滋病难关,人类还需要多长时间呢?
回答这个问题,就让我们看看目前在艾滋病研究上的重要进展吧。
先说说1个月前《Science》上发的一篇报道:艾滋病毒(HIV)进化了,出现更具毒性,更具传染性的变异株。事实上,HIV持续在进化,但毒性更强的病毒可能不太容易传播,因为在杀死宿主时,它会减少传播的机会。但毒力和传播性存在内在联系,因此要维持或增加传染性,病毒必须具有毒性。
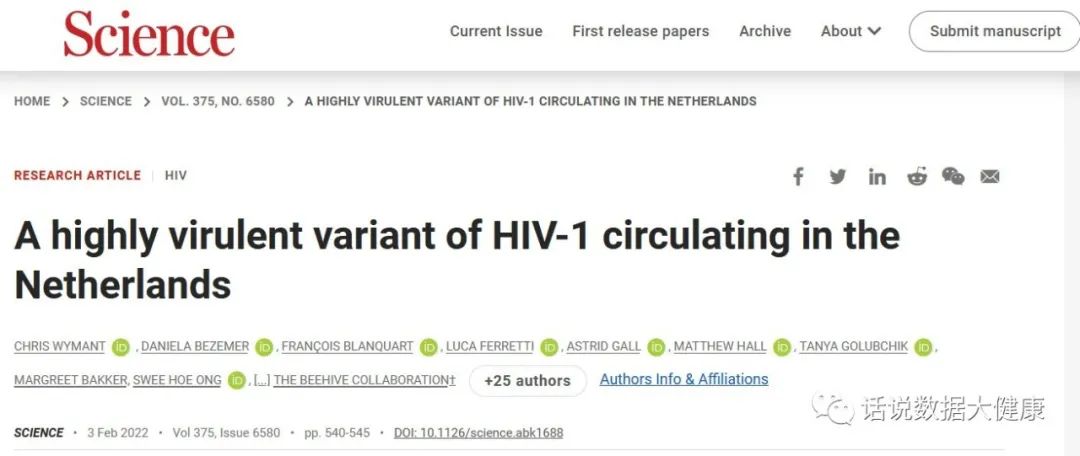
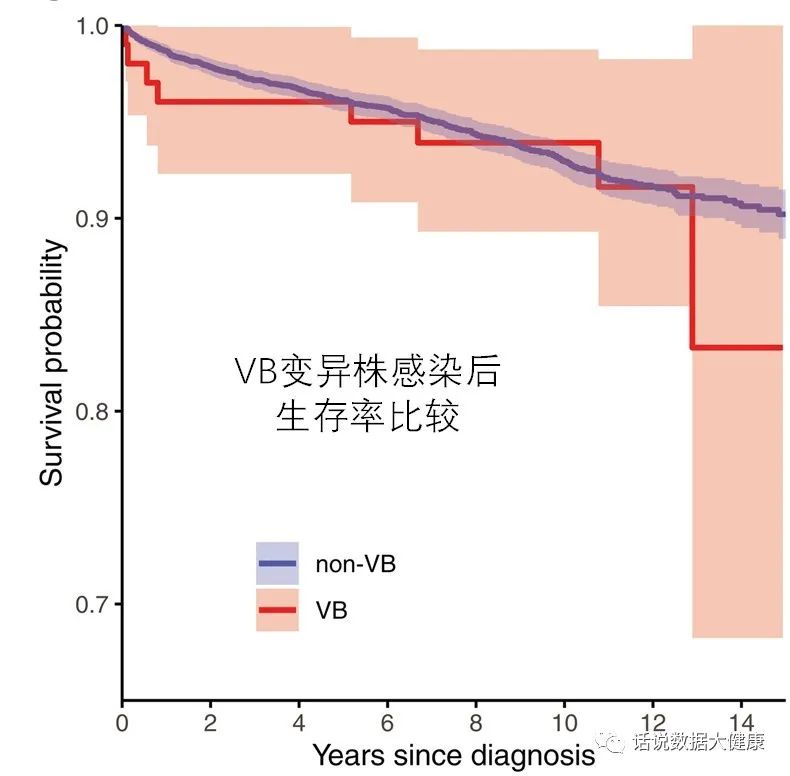
这种HIV变异株(HIV-1亚型B变体,VB变体)已在荷兰流行了多年,最早可追溯到1990年代后期。感染这种VB变异株后,患者体内病毒载量比原始毒株高3.5-5.5倍,意味着更容易将病毒传染给他人。此外,患者体内CD4+T细胞数据下降速度是普通HIV感染后的2倍。被确诊感染VB变异株后,这些人很容易2-3年内患上艾滋病。
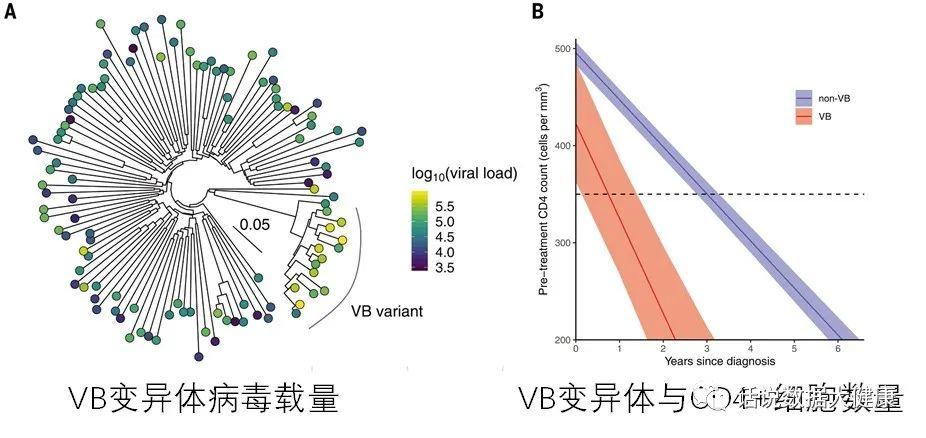
幸运的是,尽管治疗前HIV变异株感染者CD4+细胞数量下降很快,但治疗后CD4+细胞数量以及死亡率与未变异HIV感染者相比,均没有差异。这也意味着早期监测和及时治疗对VB变体感染者非常重要。
再来看一则消息,上个月在美国丹佛举办的第29届逆转录病毒和机会性感染会议上,一支研究团队宣布一名来自美国的中年女性可能成为史上第3名被治愈的HIV感染者。该感染者2013年被诊断感染了HIV,2017年诊断出患有急性髓细胞性白血病,随后接受来自捐献者的脐带血移植以及来自亲属的造血干细胞移植。14个月前开始停用抗HIV药物,至今体内未在检出HIV。脐带血捐献者体内携带一种罕见的、可以阻止HIV侵入细胞的突变。

再往前看,2020年来自英国伦敦的团队宣布全球第2例艾滋病患者成功治愈。该HIV感染者是在诊断患有霍奇金淋巴瘤后进行了造血干细胞移植。移植30个月后,体内均未能检出HIV。造血干细胞供体存在着CCR5特殊变异。


那全球第1例被治愈的HIV感染者呢?这就是著名的“柏林病人”——Timothy Ray Brown。他于1995年被确诊感染HIV,2007年因白血病接受了造血干细胞移植,2008年被宣布治愈,无需抗HIV治疗,体内HIV载量也低到无法检出。与“伦敦病人”相似,“柏林病人”接受的造血干细胞供体同样是CCR5Δ32缺失的纯合供体。

然而,第1例和第2例被治愈的HIV感染者都在承受异体移植带来的长期排斥反应。并且,治愈成功率并不高。很多经过相同突变供体移植治疗的HIV患者出现肿瘤复发死亡或HIV载量下降后又上升的情况。相比较而言,第3例“美国病人”接受了有着特殊突变的脐带血移植,并未出现移植物抗宿主反应,这似乎可以成为HIV治疗新的方向。
这里可能会存在一个疑问,为什么这些供体存在的基因突变能够对抗HIV感染?存在着这些基因突变的人多吗?其实,并不是每一个感染艾滋病毒的患者都会出现症状。有那么极少数的艾滋病毒感染者(不到0.5%)体内能够自发地控制艾滋病病毒的复制,一生都不出现临床症状。这极少数人群被称为“精英控制者”。2020年来自《Nature》上的研究论文就对这些精英控制者的基因组进行了测序,发现他们体内也有与其他感染者一样的具有复制能力的病毒储存库。但在精英控制者中艾滋病毒的插入位置有显著差异,这意味着在他们体内病毒的复制受到抑制,处于深度休眠状态。但深度病毒潜伏期并不是完全永久或不可逆的。潜伏期很可能是一个动态过程,尽管整合位点的基因组和表观遗传特征限制了病毒基因的表达治愈艾滋病,但偶尔可能会发生病毒转录的爆发。
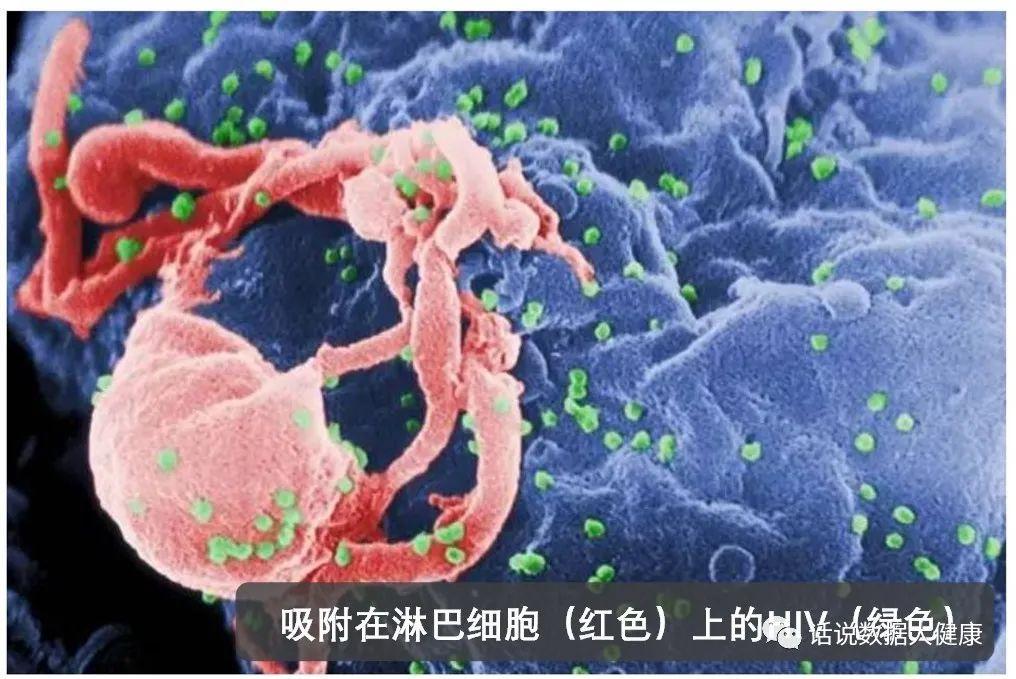
既然大部分HIV感染者体内并没有这种抗HIV的基因,咱们通过基因编辑手段来改造相关基因是不是也可以治愈HIV呢?毕竟不是每个HIV感染者都能够像上述“柏林病人”和“伦敦病人”那样,能够得到非常稀少的突变者供体造血干细胞。不得不说这个想法很聪明。2019年来自国内解放军307医院和北京大学等机构的联合团队的确利用基因编辑在HIV治疗上进行了尝试。该团队采用基因编辑的干细胞破坏HIV感染者细胞中的CCR5,摧毁HIV感染的入侵通路。

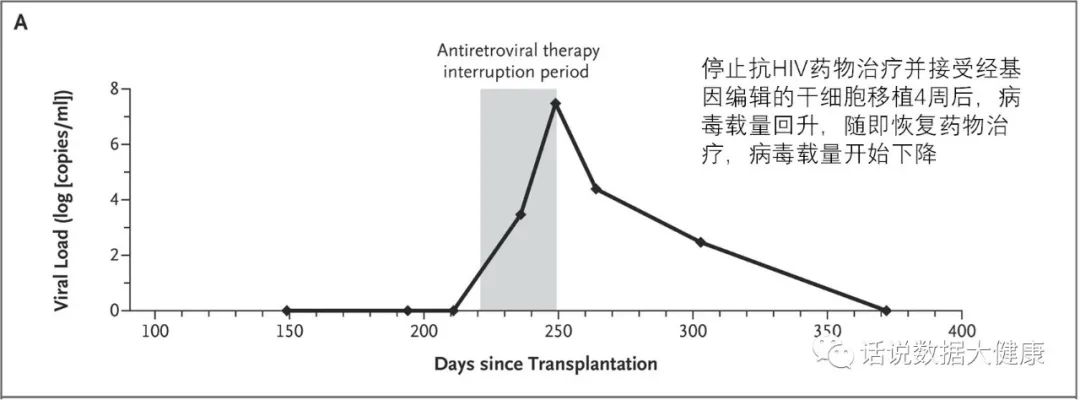
接受此项基因编辑治疗的患者为27岁男性,2016年诊断感染有HIV,并被确诊患有急性淋巴细胞白血病,后接受抗HIV药物治疗。2017年与一名33岁男性供体配型成功,但这名供体CCR5基因并没有突变。研究团队随后对供体的部分CD34+细胞的CCR5进行基因编辑,输入到HIV感染者体内。遗憾的是,在停止抗HIV药物治疗4周后,HIV病毒载量回升,基因编辑治疗失败,只能恢复药物治疗。尽管如此,在HIV患者中可以检测到经修饰CCR5基因的细胞持续存在。研究者认为目前基因编辑下CCR5靶向效率低,应答率还不足以治愈HIV。

除了干细胞移植和基因编辑途径外,药物治疗也有新进展。对于一般艾滋病患者而言治愈艾滋病,潜伏着病毒的静息免疫细胞是治愈艾滋病的最大障碍。虽然采用抗逆转录病毒疗法可以起到治疗效果,但对潜伏细胞没有作用。2020年在《Nature》发表的另两篇文章就利用不同的方法激活猴和小鼠体内潜伏免疫细胞内的休眠病毒,接着采用上述的抗逆转录病毒疗法将艾滋病病毒杀死。这也可能成为治愈艾滋病的新途径。
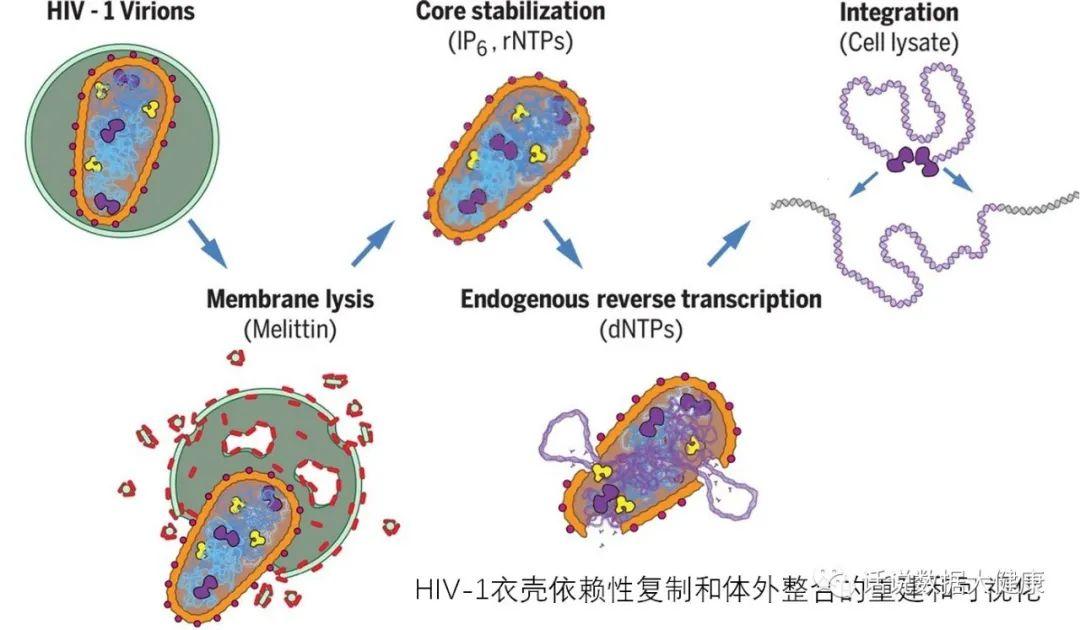
很久以前科学家就意识到艾滋病病毒将自己的病毒基因组整合到人类受到感染的细胞基因组中。但这些病毒颗粒深藏于细胞核中,科学家难以对其机制深入研究。最近《Science》发表的一篇论文构建了一个无细胞的体系,首次让艾滋病在体外依次完成逆转录和整合,并首次发现病毒的衣壳在逆转录和整合中起到了关键作用。如果能够研发出针对衣壳蛋白的药物,可能对治愈病毒有效。
通过上述研究,了解到在艾滋病的治疗上是多方向研究同步进行的,发现了多种潜在的治愈方法,比如带有特殊突变的干细胞移植、基因编辑干细胞移植、HIV休眠期治疗以及HIV新靶点的治疗等。当然,针对HIV的治疗研究很多,进展很快,但这同时也意味着目前临床上还难以有效地实现艾滋病治愈。

既然HIV感染治愈还难以实现,那么预防HIV呢,目前有没有可以预防HIV的疫苗呢?后续接着谈。
参考文献
N Engl J Med. 2009
N Engl J Med. 2019
Lancet HIV. 2020
Nature. 2020
Science. 2020
Science. 2022



