曾经,“HIV阳性”就是一张死刑判决书。
1980年代末和1990年代初,艾滋病的致死率极高,许多患者在感染艾滋病病毒(HIV)后迅速发展为艾滋病,并在短时间内死亡。以1996年为例,那时一名20岁确诊艾滋病的患者,有极大可能在39岁就不幸离世。
如今,HIV感染者的前景发生了翻天覆地的变化,许多人的寿命甚至与未感染HIV的同龄人相同。2011年时, 20岁确诊艾滋病的患者,平均寿命已经延伸到了70岁左右(Marcus et al., 2016)。
这一惊人的改善主要要归功于“鸡尾酒疗法”的崭露头角。

图源:摄图网
鸡尾酒疗法,原名抗逆转录病毒疗法(ART),是一种每日服用多种药物的治疗方案。它能够将人体血液中HIV的水平降低到几乎无法检测的程度,不仅使病毒无法传播给他人,还有助于增强患者的免疫力,减缓疾病的进展(WebMD,2023)。
然而,需要明确的是,尽管鸡尾酒疗法能够控制病情,但并不能根治艾滋病,因为HIV仍然在免疫系统的辅助T细胞中休眠。一旦停药,病毒便会重新活跃,构成威胁(HIV i-BASE,2022)。
对于一些患者来说,坚持每天服药并非易事,而且这种治疗并不普及。但在过去的15年里,一些患者不仅在停止ART,甚至不依赖药物的情况下,成功将体内HIV水平降至不可检测的程度(Kristin Houser,2023)。
这意味着,人类距离实现治愈艾滋病或许仅差一步之遥。
成功打败HIV的6个人
1995年,Timothy Ray Brown在柏林上大学时被诊断患有艾滋病治愈艾滋病,并开始接受ART治疗。然而,2006年,他被诊断患有急性髓性白血病(AML),随后接受了化疗,并计划在2007年进行骨髓干细胞移植。
命运的齿轮在这一刻开始转动。
Brown的医生选择了一位携带“CCR5 Delta 32”基因突变的捐赠者,这一突变可以使人们对HIV感染完全免疫。
移植后,Brown停止了ART治疗。三个月后,医生在他的血液中无法再检测到HIV的存在。
这一奇迹在2008年被公布,Brown因此成为了首位艾滋病毒治愈者,被称为“柏林病人”。直到2020年他因癌症去世之前,他的体内一直未检测到HIV(BBC,2020)。

图源:德国杂志Stem
2019年、2020年和2022年,另外三位与柏林病人情况类似的艾滋病患者,亦成功通过接受携带CCR5 Delta 32基因的干细胞移植,“治愈”了艾滋病(Reuters,2022)。
尽管这一疗法效果显著,但并非永久性解决方案。
骨髓干细胞移植手术成功率微小,寻找到携带这一基因突变的捐赠者也极具挑战性。此外,手术费用昂贵,对于已经接受常规艾滋病治疗的患者来说,经济负担巨大。
为了克服这些限制,加州大学洛杉矶分校的团队通过移植了一名携带CCR5 Delta 32基因的脐带血干细胞,于2017年成功治愈了一名患有艾滋病毒白血病的混血女性(Kristin Houser,2022)。
此外,据今年7月报道,研究人员宣布一名被称为“日内瓦病人”的男子成为迄今治愈艾滋病时间最长的患者。值得注意的是,该患者于2018年接受了不携带CCR5 Delta 32基因的干细胞移植手术,至今研究人员仍未在其体内发现HIV的迹象(科技日报,2023)。
CRISPR基因剪刀或能一次解决?
除了外部基因干预来抑制HIV病毒活性,科学家还着力研发内部瓦解病毒的方法,其中CRISPR基因编辑技术引起广泛关注。CRISPR(Clustered Regularly Interspaced Short Palindromic Repeats)是一种先进的基因编辑工具,可精确定位和修改DNA序列。
2019年7月,美国坦普尔大学的研究人员成功使用CRISPR-Cas9技术在可产生人类T细胞的小鼠中治疗HIV。治疗结束后,小鼠中有约三分之一的HIV感染已经完全被消除(36氪,2019),这是基因编辑技术首次实现HIV的消除。
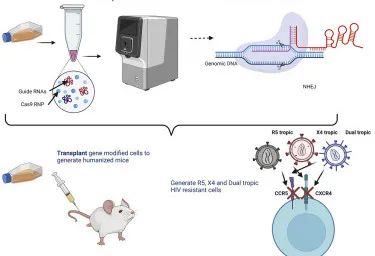
图源:Cell
2020年11月,美国天普大学和内布拉斯加大学医学中心的研究人员在《自然通讯》期刊上发表了一项研究,成功在非人灵长类动物的基因组中编辑并清除了与HIV密切相关的SIV-a病毒,这是艾滋病研究的重要进展(转化医学网,2020)。
今年,美国一家大型生物技术公司在欧洲基因与细胞治疗学会(ESGCT)年会上宣布,他们的EBT-101版本成功治疗了携带SIV(猴免疫缺陷病毒)的猴子治愈艾滋病,并证明了CRISPR系统的安全性和有效性。EBT-101通过单次静脉注射无害病毒,能够发现隐藏在辅助T细胞中的HIV,然后切除其DNA,防止再次复制和扩散。
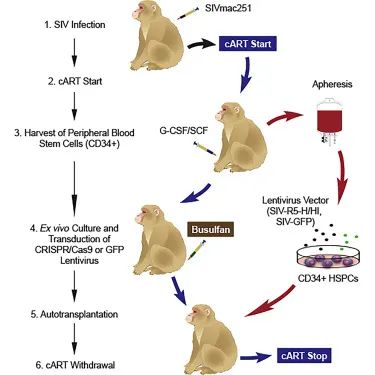
图源:Molecular Therapy
该公司目前已启动人体临床试验,招募了9名正在接受ART治疗的HIV感染者,旨在评估EBT-101的安全性和耐受性。试验计划于2025年3月结束,并且对参与者的随访将持续15年,以评估CRISPR治疗的长期效果(CRISPR Medicine News,2023)。
然而,这一疗法也受到一些质疑。荷兰研究人员近期在《病毒学杂志》发表的研究中指出,CRISPR/Cas9基因编辑技术可能会意外改变邻近基因序列,从而激活原癌基因,增加癌症风险(aidsmap,2023)。
抗癌药物是治疗艾滋的“神助攻”?
在治愈艾滋病的道路上,我们已经取得了一些令人鼓舞的进展。许多抗癌药物和治疗方法已经应用于HIV研究中,包括HDAC抑制剂、PD-1抑制剂和治疗性疫苗。

这不是巧合,因为癌症和艾滋病都与细胞DNA突变有关。癌症的突变发生在宿主DNA中,而HIV感染则是由病毒引入的,但两者都与所谓的“流氓基因”有关(Aidsmap,2023)。
因此,通过研究专门针对癌症细胞的药物将有助于我们更深入地探索治愈艾滋病的可能性。
在众多抗癌药物中,Venetoclax已经走在了HIV治疗研究的前沿。一项研究表明,Venetoclax可以减少小鼠体内HIV的复制(Arandjelovic P et al., 2023)。这项实验使用经过“人类化”处理的小鼠感染HIV,并在治疗期间给予Venetoclax,结果显示,Venetoclax显著减缓了HIV的反弹速度,表现出卓越的抗病毒效果。
此外,研究还发现,Venetoclax能够有选择性地清除完整的HIV DNA,而不影响缺陷的HIV DNA。这一发现表明,Venetoclax可能有望有针对性地标记携带活跃HIV DNA的免疫细胞,为治愈提供新的可能性。

图源:摄图网
另一种名为Obatoclax的药物也表现出相当的潜力。
Obatoclax是BH3模拟药物家族的一员,是BCL-2和MCL-1的抑制剂。研究结果显示,Obatoclax显著减少了细胞样本中完整HIV DNA的数量,平均减少了83%,这为治疗提供了新的方向(HIV i-BASE,2023)。
虽然我们仍然面临许多挑战,但这些研究结果让我们对治愈艾滋病的前景充满信心,为未来的疗法和方法开辟了新的可能性。
距离完全治愈艾滋病,人类还差多远?
离完全治愈艾滋病,人类还有一段艰难的路要走。尽管如此,我们也见证了许多令人鼓舞的进展,使人们更容易与这一病毒共存。
例如,现在有了可以每月或每两个月注射一次的抗逆转录病毒治疗药物,这相比于每天口服药物而言,为感染者带来了更方便的选择(Drugs,2023)。

此外,新的艾滋病毒感染预防方法也不断涌现,包括阴道环和每两个月注射一次的预防药物(Kristin Houser,2021)。这些创新为降低感染风险提供了额外的手段。
更令人期待的是,多种HIV疫苗正在进行临床试验,其中一些采用了先进的mRNA技术(Healio,2023)。如果这些疫苗在临床试验中取得成功,将为全球范围内艾滋病毒感染率较高的地区带来希望和改变。
虽然路途难免崎岖,但对于最终战胜艾滋病这一伟大目标的追求将继续不懈。相信未来,我们将迎来一个更加包容和健康的社会,艾滋病将不再是一个不可战胜的威胁,而成为我们成功抵抗并战胜的疾病之一。
Editor
编辑
好医生-李可意
Reference
参考
Marcus, J. L., Chao, C. R., Leyden, W. A., Xu, L., Quesenberry, C. P., Jr, Klein, D. B., Towner, W. J., Horberg, M. A., & Silverberg, M. J. (2016). Narrowing the Gap in Life Expectancy Between HIV-Infected and HIV-Uninfected Individuals With Access to Care. Journal of acquired immune deficiency syndromes (1999), 73(1), 39–46.
i-Base. (2022, April 1). The natural history of HIV without ART. ART in pictures: HIV treatment explained. Retrieved November 30, 2023, from
Gallagher, J. (2020, September 30). Berlin patient: First person cured of HIV, Timothy Ray Brown, dies. BBC News. Retrieved November 30, 2023, from
WebMD. (2023). How Do You Treat HIV? Retrieved November 30, 2023, from
Reuters. (2022, July 27). Oldest patient yet cured of HIV after stem cell transplant – researchers. Retrieved November 30, 2023, from
FreeThink. (n.d.). Woman cured of HIV. Retrieved November 30, 2023, from
NBD. (2023, July 24). [Title of the article in Chinese]. Retrieved November 30, 2023, from
[Username or real name if available]. (n.d.). [Title of the Weibo post if available]. Weibo. Retrieved November 30, 2023, from
QQ News. (2020, November 18). [Title of the article in Chinese]. Retrieved November 30, 2023, from
CRISPR Medicine News. (n.d.). Clinical trial update: Positive clinical data for first-ever CRISPR therapy for HIV. Retrieved November 30, 2023, from
Cell Reports Medicine. (2023). [Title of the article]. Cell Reports Medicine. Retrieved November 30, 2023, from (23)00331-2
i-Base. (n.d.). [Title of the article]. Retrieved November 30, 2023, from
Drugs.com. (n.d.). Cabenuva: Uses, Dosage, Side Effects, Warnings. Retrieved November 30, 2023, from
FreeThink. (n.d.). Vaginal ring HIV prevention. Retrieved November 30, 2023, from
Healio. (2023, April 17). HIV vaccine research at a crossroads after recent failures. Retrieved November 30, 2023, from
Notice
说明



