艾滋病,是人类获得性免疫缺陷综合征的简称,因感染人类免疫缺陷病毒(HIV)引起。HIV病毒主要攻击人体的辅助T淋巴细胞系统(尤其是CD4+T细胞),一旦侵入机体细胞,病毒将会和人体细胞整合在一起,终生难以消除。经过数年、甚至长达10年或更长的潜伏期后,HIV病毒感染者最终发展成艾滋病病人,此时人体丧失免疫功能,因抵抗力极度下降会出现多种感染,后期常常发生恶性肿瘤,以至全身器官衰竭而死。
自1981年6月5日,美国疾病预防控制中心第一次报道艾滋病以来,目前全世界有超过3600万人感染艾滋病,死亡人数高达1200万。截至2018年,我国报告现存活艾滋病感染者近80万,近几年每年新增超过5万。但据世界卫生组织WHO估算,中国实际艾滋病感染者约为125万。
全世界的科学工作者对艾滋病已经进行了近40年的研究,目前,联合使用多种药物的鸡尾酒疗法已经使得HIV感染从一个致死绝症变为对预期生存寿命影响不大的慢性疾病。但是艾滋病治愈,临床使用的HIV药物仍然面对着不断出现的HIV耐药株的挑战。几乎所有药物在单药使用情况下都会在几个月至几年间诱导耐药株产生。针对新靶点的HIV抑制剂将有望用于治疗现有药物的HIV耐药株感染。
更重要的是,目前的HIV药物无法治愈HIV,需要终生服药。HIV的治愈途径中,“激活和杀灭”(shock and kill)是目前基础研究最多的策略之一。该策略主要通过激活HIV潜伏库细胞,再杀灭激活的感染细胞和病毒,但是目前能同时直接杀灭感染细胞和病毒的HIV药物仍较为缺乏。
针对以上问题,复旦大学陆路/姜世勃团队联合中国医学科学院秦川团队于2020年6月3日在Science Translational Medicine上发表题为:An amphipathic peptide targeting the gp41cytoplasmic tail kills HIV-1 virions and infected cells 的论文,筛选得到了针对新靶点的抗HIV多肽。

该多肽——F9170来源于HIV包膜蛋白(Env)胞内区,能有效抑制以及失活HIV感染,即在病毒感染靶细胞前就能使病毒失去感染能力,与以往需要等病毒结合甚至进入复制周期的药物显著不同。
进一步的机制研究表明, F9170靶向HIV包膜蛋白胞内区LLP1结构域,多肽与Env胞内区的相互作用在病毒包膜上形成亲水通道,最终使得HIV的基因组释放,失去感染能力。该多肽同时也能作用于表达了HIV Env的HIV感染细胞,以及激活后的HIV储存库艾滋病治愈,引起感染/激活细胞的坏死,所以F9170或将有望与储存库激活剂一起用于HIV感染的治愈。
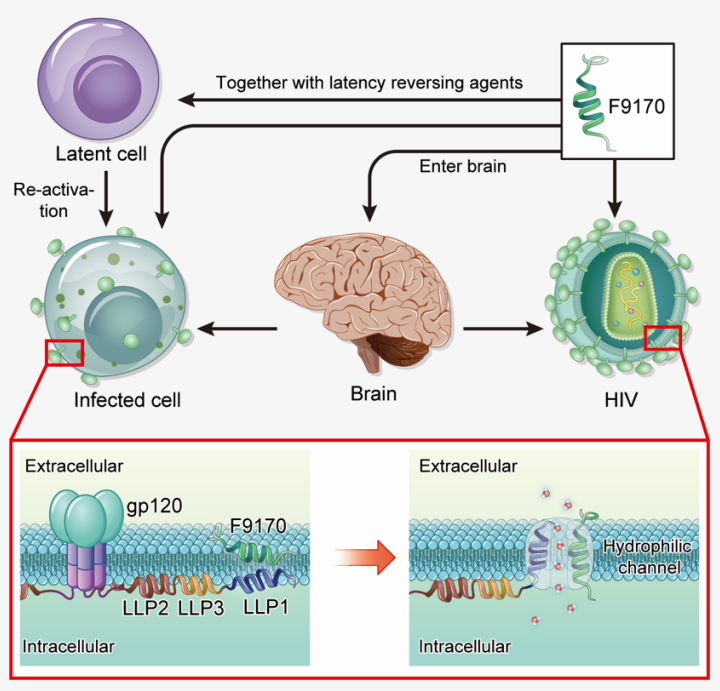
多肽F9170作用机制示意图
F9170在小鼠体内的安全性试验证明,该多肽不会影响小鼠体重,不造成肝肾毒性与神经毒性,也没有诱导出抗F9170抗体,具有成药的可能性。
在SHIV慢性感染的恒河猴模型中,F9170的短期单独使用可将恒河猴体内的病毒载量迅速控制到检测线以下。同时,F9170在恒河猴体内的半衰期可达8-11个小时,高于以往的多肽药物。并且,在药物体内分布实验中,在小鼠大脑和淋巴结都能检测到药物信号,而这两个器官都是目前较为公认的HIV潜伏库的位置。
因此,F9170确实有望成为HIV治疗甚至治愈的候选药物。F9170的作用机制也与以往药物较为不同,并不破坏靶点的生理作用,只是利用跟靶点的相互作用,破坏胞膜完整性,为其他病毒药物的开发也拓宽了思路。



