
撰文 | nagashi
艾滋病(AIDS)最早发现于1981年艾滋病治愈,是一种由人类免疫缺陷病毒(HIV)引起的、危害性极大的传染病。虽然抗逆转录病毒疗法(ART)的不断进步使得艾滋病患者的寿命和预后大大延长,但也会带来严重的副作用。
更重要的是,HIV作为一种逆转录病毒,它可以将其基因组整合到宿主细胞的染色体上,这意味着仅依靠抗逆转录病毒疗法(ART)是不可能彻底治愈艾滋病患者的。这也迫使科学家们不断寻找新的艾滋病治疗方法。
2020年11月27日,美国天普大学和内布拉斯加大学医学中心的研究人员在 Nature Communications 杂志上发表了题为:CRISPR based editing of SIV proviral DNA in ART treated non-human primates 的研究论文。
这项研究成功地在非人灵长类动物的基因组中编辑清除了与HIV密切相关的SIV-a病毒,这在艾滋病研究中迈出了重要一步。这一突破也使得人类比以往任何时候都更接近于开发出彻底治愈艾滋病的方法。

猴免疫缺陷病毒(SIV),是一种可影响至少33种非洲灵长目的逆转录病毒,在非人类灵长类动物中,SIV的行为与HIV非常相似。因此,被SIV感染的恒河猴模型是模拟感染HIV的人类艾滋病患者的最理想的大型动物模型。
与此同时,CRISPR技术作为一种新兴技术,在基因编辑、基因治疗、核酸定位及核酸检测等领域被广泛应用,今年10月7日,2020年诺贝尔化学奖授予了两位科学家——Emmanuelle Charpentier和Jennifer A. Doudna,以表彰她们在CRISPR基因编辑领域的做出的杰出贡献。

2020年诺贝尔化学奖得主——Emmanuelle Charpentier(左)和Jennifer A. Doudna(右)
对此,科学家们指出,可以将CRISPR技术应用于艾滋病的治疗中,以此彻底消灭那些整合到宿主细胞染色体上的HIV。
在此项研究中,研究人员首先设计了一种SIV特异性的CRISPR-Cas9基因编辑工具,他们通过细胞培养实验证实,该编辑工具可以在染色体的正确位置切割整合的SIV的DNA,且在脱靶位点进行潜在有害基因编辑的风险有限。
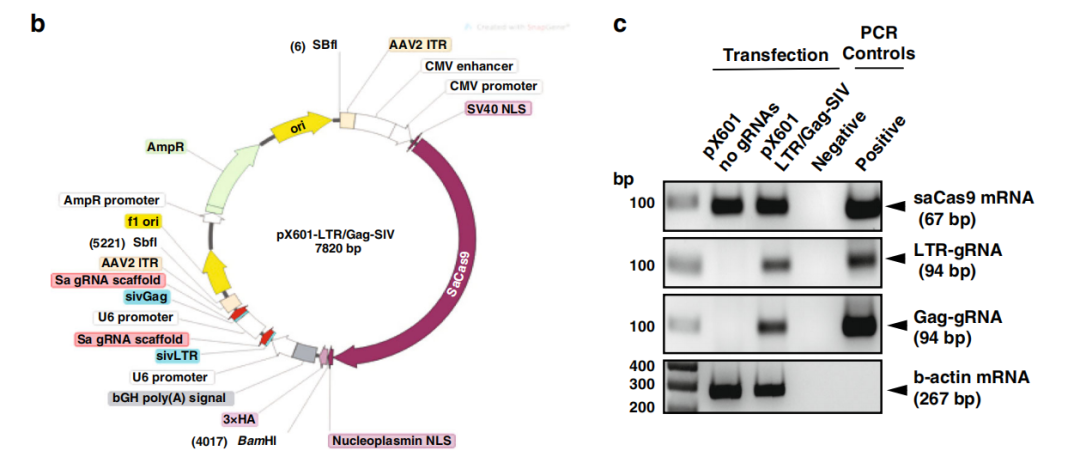
体外靶向SIV整合DNA的CRISPR-Cas9基因编辑工具的构建、图谱和效果确认
随后,研究团队将该CRISPR-Cas9基因编辑结组分包装到腺相关病毒9型(AAV9)载体中,并随机挑选了三只恒河猴,其中两只接受一次AAV9-CRISPR-Cas9注射,另一只猕猴作为对照。三周后,研究人员从这些恒河猴身上采集血液和组织。
样品分析表明,在AAV9-CRISPR-Cas9处理的恒河猴中,该特异性靶向SIV的CRISPR-Cas9基因编辑系统已经广泛分布到骨髓、淋巴结和脾脏等组织,并已到达CD4+ T细胞——HIV的重要宿主细胞。
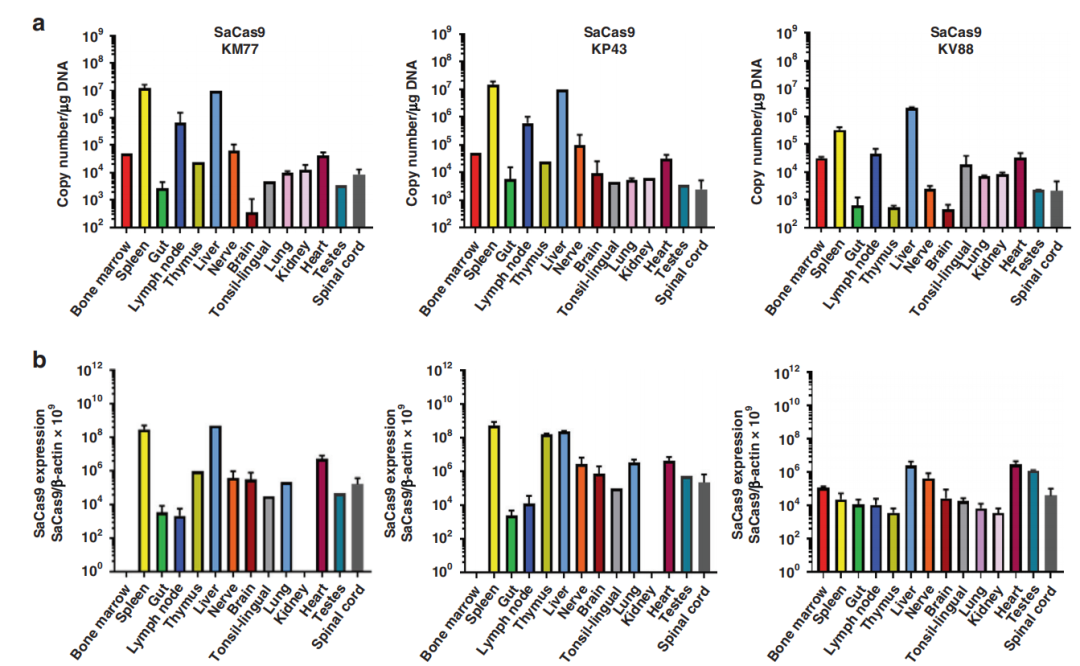
CRISPR-Cas9载体在组织中的生物分布
研究人员通过遗传分析发现,两只静脉注射了AAV9-CRISPR-Cas9的恒河猴,其体内的SIV整合基因组已经有效地从感染细胞中清除。虽然不同组织的清除效率有所不同,但相对而言,淋巴结的清除效率相当高!
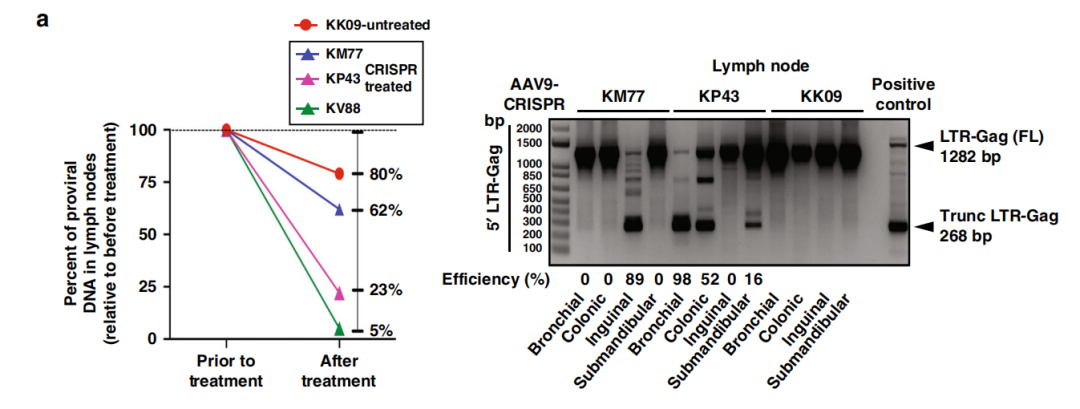
CRISPR-Cas9在感染SIV的恒河猴血液和组织中切除SIV的整合DNA
不仅如此,研究团队还在其他动物模型中做了类似实验,并证实他们的AAV9-CRISPR-Cas9系统可以有效地从感染了HIV-1的人源化小鼠模型的细胞和组织中清除HIV-1的整合DNA。
本研究的主要领导者 Kamel Khalili 教授表示:我们希望很快将这项工作推进到人类的临床研究,全世界已经受艾滋病毒感染威胁40年了,我们现在已经非常接近临床研究,有望找到治愈艾滋病毒感染的方法。
总而言之,这是一项十分重要的研究进展艾滋病治愈,并有望以此彻底终结人类的艾滋病噩梦。接下来的研究需要在更长一段时间内评估这种治疗方法,以确定该方法是否能够彻底清除HIV病毒,甚至可以让受试者不再需要接受抗逆转录病毒治疗。
论文链接:



