20 世纪 80 年代至今,在人类的认知里,艾滋病是无法根治的世界五大绝症之一。但事实上,史上第二例击败艾滋病的患者已经出现了。
雷锋网了解到,这位患者被称为“伦敦病人”,在中断治疗 30 个月后血液、脑脊液、肠组织或淋巴组织中均未检测到具有复制能力的病毒。
伦敦大学学院感染与免疫学系教授 Ravindra K. Gupta团队对“伦敦病人”的研究成果已先后在《自然》杂志(Nature)和《柳叶刀》(The Lancet)旗下《柳叶刀-艾滋病》(The Lancet HIV)两大顶级期刊发表。
中断治疗后 18 个月体内未检测出 HIV 病毒
当地时间 2019年 3月 5日艾滋病治愈,《自然》杂志刊登了 Ravindra K. Gupta团队对名为HIV-1 remission following CCR5Δ32/Δ32 haematopoietic stem-cell transplantation(CCR5Δ32/Δ32 造血干细胞移植后 HIV-1 的缓解)的论文。
实际上,CCR5基因是HIV 入侵 T 细胞的主要共受体。而 CCR5-Δ32又是 CCR5 的一种突变基因,天然具备抵御 HIV 的能力。
根据论文,研究人员利用 CCR5Δ32/Δ32 供体的细胞对患者进行了霍奇金淋巴瘤的同种异体造血干细胞移植(HSCT),患者在接受干细胞移植治疗后 16 个月抗逆转录病毒治疗中断,此后的 18 个月其体内也并未检测出 HIV 病毒。

雷锋网(公众号:雷锋网)了解到,CD4 细胞是人体免疫系统中的一种重要免疫细胞,是艾滋病病毒的攻击对象,所以其检测结果对艾滋病治疗效果以及对患者免疫功能的判断都有着重要作用。
移植前,研究人员在患者 CD4细胞的 HIV-1 DNA 中鉴定出 CCR5 而非 CXCR4 嗜性病毒。
移植后,研究人员在患者外周血中分离的 CD4 T 细胞不表达 CCR5,并且仅在体外对 CXCR4 嗜性病毒敏感,同时 HIV-1Gag 特异性 CD4 和 CD8 T 细胞应答丧失,而可检测到细胞特异性应答。
据悉,研究团队通过2400 万个静止的 CD4 T 细胞,均未检出患者血浆 HIV-1 RNA 和外周 CD4 T 淋巴细胞中的 HIV-1 DNA。
对于上述数据,Ravindra K. Gupta团队也表示,尽管还无法得出该患者已被治愈的结论,但数据已经表明:具有同功酶 CCR5Δ32 供体细胞的单个同种异体 HSCT 可能足以在强度降低且无辐射的情况下实现 HIV-1 缓解。这也为基于预防 CCR5 表达的 HIV-1 缓解策略的发展提供了进一步支持。
治疗中断 30 个月后 HIV-1 治愈
实际上,“伦敦患者”在造血干细胞移植治疗中断 30 个月后,体内仍未检测出 HIV 病毒。
当地时间 2020年 3月 10日,《柳叶刀-艾滋病》刊登了名为Evidence for HIV-1 cure afterCCR5Δ32/Δ32 allogeneic haemopoietic stem-cell transplantation 30 months post analytical treatment interruption: a case report(CCR5 Δ 32/Δ 32 异基因造血干细胞移植治疗中断 30 个月后 HIV-1 治愈的证据:1 例病例报告)的研究成果。

研究方法主要包含:
利用患者的血浆、精液和脑脊液样品,通过超灵敏病毒载量测定检测 HIV-1 RNA;
在肠组织、淋巴结组织活检中,使用微滴式数字 PCR(DDPCR)技术和定量实时 PCR技术,检测细胞拷贝数和总 HIV-1 DNA 水平;
使用靶向包装信号(ψ)和包膜(Env)的多重微滴式数字 PCR 技术,分析完整的前体 DNA 的存在;
通过胞内细胞因子染色,测量 HIV-1 特异性 T 细胞应答;
用低敏感性和低亲和力抗体检测人类对 HIV-1 的反应;
利用数学模型和推断方法来预测反弹的概率。
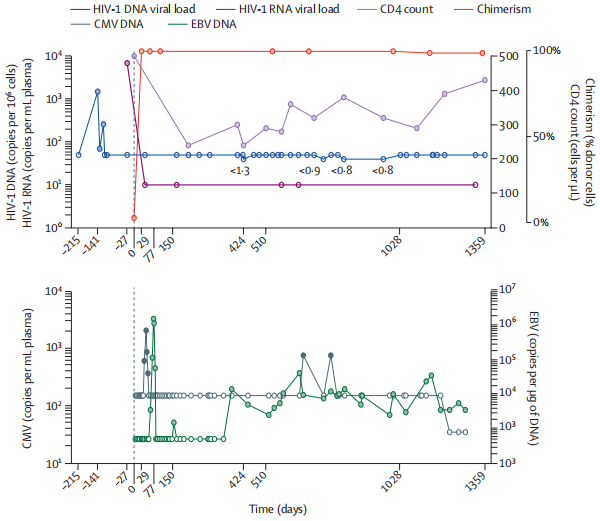
根据上述方法,研究团队得到数据(具体见下图):
根据检测下限为 1拷贝/毫升的测定,血浆中 HIV-1 病毒载量保持不可检测的状态已达 30 个月(最后一次检测是在 2020 年 3 月 4 日);
在第 28 个月时,CD4 计数为 430 个/μL(占总 T 细胞的 23.5%),在外周 CD4 记忆细胞中记录到 HIV-1 DNA 的非常低水平的阳性值;
在第 27个月时,腋淋巴结组织末端重复(33 拷贝/106 个细胞)和 Env(26.1 拷贝/106 个细胞)为阳性,ψ 和整合酶为阴性,完整的前脑 DNA 检测为阴性。HIV-1 特异性 CD4 和 CD8 T 细胞应答仍不存在。低亲和力的 Env 抗体继续下降;
在第 25个月时,CSF 在正常参数内,HIV-1 RNA 低于检测下限(检测下限[LLD] 1 拷贝/毫升);
在第 22 个月时,直肠、盲肠、乙状结肠和末端回肠组织样品中的 HIV-1 DNA呈阴性;
在第 21个月时,精液中的病毒载量在血浆(LLD
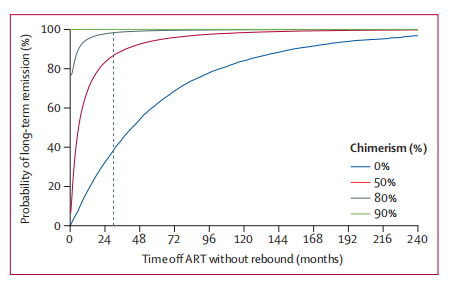
如下图所示,研究团队根据数学模型得出了结论——该患者在总 HIV 靶细胞中供体嵌合率为 80% 的情况下,终生缓解(治愈)率为 98%;在供体嵌合率为 90% 的情况下,终生缓解率大于 99%。
至此,Ravindra K. Gupta团队对该患者病情改善的评估由“长期缓解”变为“治愈”,确认“伦敦病人”是人类历史上第二位被治愈的艾滋病患者。
“不要惧怕艾滋病”
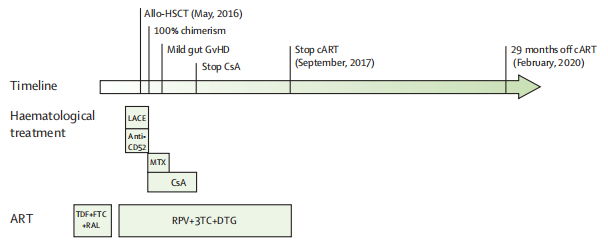
值得一提的是,这位“伦敦病人”的身份也被公开:名为Adam Castillejo,现年 40 岁。2003 年被检测出感染有 HIV 病毒,2012 年开始服用抗病毒药物治疗,因为罹患霍奇金淋巴瘤,在 2016 年 5月接受了干细胞移植治疗,并在 2017年 9月中止治疗(时间线如下图所示)。
实际上,除了“伦敦病人”,还有一位“柏林病人”Timothy Ray Brown,他便是首位被成功治愈的艾滋病患者,也是此前唯一一个被成功治愈的艾滋病患者。
雷锋网了解到,2007 年,居住在柏林的 Timothy Brown被确诊患上急性白血病。鉴于 Timothy Brown的状况,其主治医师打算寻找携带 CCR5-Δ32 突变基因的骨髓捐献者,在经历 61 次尝试后,成功找到了一个携带有 CCR5突变基因的骨髓配型。
幸运的是,在接受骨髓移植后,Timothy Brown体内的 HIV 病毒彻底消失,至今已超过十年时间。

对于上述两个成功治愈的病例艾滋病治愈,澳大利亚墨尔本 Peter Doherty 感染与免疫研究所负责人 Sharon Lewin认为:
从他们的治愈过程中,可以借鉴治愈艾滋病的策略,可能会有很广泛的应用。
另外,宾夕法尼亚大学的艾滋病研究者 James Riley也对其指导意义表示肯定:
“柏林病人”本是一个 n=1 的实验,需要一个原理来证明。而“伦敦病人”则是“n=2”。
不过,考虑到两例患者的特殊性,大部分研究人员依然不认为这种治疗方案可供推广。不仅是费用,风险也很大,美国艾滋病病毒医学协会前会长迈克尔・扎格曾表示:
目前,干细胞疗法或骨髓移植常用于癌症治疗,其原理是利用强力药物和放射物摧毁人体原有的免疫系统,然后输入捐献者的骨髓重造一个新的免疫系统,这种疗法及其并发症会提高死亡率,其风险尚未可知。
目前而言,提升艾滋病治愈率道阻且长,但两个成功治愈的病例至少让我们更加相信艾滋病没有想象中那么可怕,正如《柳叶刀-艾滋病》主编 Peter Hayward 在接受《中国科学报》专访时所说:
不要惧怕艾滋病。
参考资料:
(20)30069-2/fulltext#%20



