在2018年,他又患上了急性髓系白血病(这个病在老年艾滋病患者中比较常见)。
为了治疗白血病,医生为其进行干细胞移植,而移植的细胞则来自于携带罕见基因突变(CCR5)的捐献者。
与第一位幸运儿“柏林病人”类似,手术后,这位患者体内的艾滋病毒似乎“消失“了——直至目前,都没有再出现复制的迹象。
不过,科学家目前还无法100%肯定上述这些患者就此“痊愈”。基于医学的严谨,要证明他们体内的艾滋病毒彻底消失,还需要更长时间的观察。

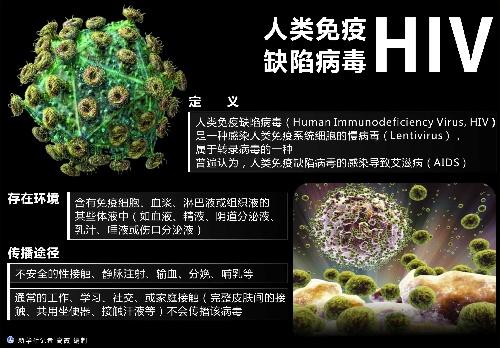
2021年,有65万人死于艾滋病毒相关原因艾滋病治愈,150万人感染艾滋病毒。截至2021年底,全球估计有3840万艾滋病毒感染者[2]。
然而,在“抗艾”四十年间,只有极个别的病例出现“痊愈”的迹象。每出现一位这样的患者,都会让大众欢欣鼓舞。
为何艾滋病如此难攻克,我们离治愈艾滋病还有多远?今天一起来了解这一“世纪难题”。

艾滋病之所以难治愈,很大的原因在于艾滋病毒具有很强的“隐身”能力。
当艾滋病毒进入人体后,它会将自己整合到几种细胞类型的宿主基因组中[3]。在那里,它们可以不断复制,制造更多的“分身”,持续攻击更多的细胞。
虽然,使用抗逆转录病毒药物可以阻断这一过程,但“狡猾”的病毒竟然会“潜伏”起来,进入休眠状态,从而可以躲过人体免疫系统和药物。一旦停止治疗,病毒又会卷土重来。
因此,想精准定位、有效打击、彻底根除艾滋病毒,是一件十分有难度的事情。
其次,艾滋病毒具有很强的突变能力。
艾滋病毒在人体内持续进行的,并不是单纯的“复制”与“粘贴”。

逆转录、重组、将病毒DNA序列转录为RNA从而全身传播……在这一持续而频繁进行的过程中,病毒很容易出错,从而导致“突变”。
每一种突变都会让免疫系统更难以识别,让治疗药物一筹莫展。科学家认为,这种频繁的突变是免疫系统无法根除病毒的主要原因之一。
因此,治疗艾滋病感染者,往往很难只用一种药物,而是通常使用鸡尾酒疗法(使用两种及以上药物联合治疗)。

“抗艾”的道路并不是一帆风顺。过去40年,全世界的科学家们在经历了许多失败与困顿之后,也取得了长足的进步,获得了一些卓有效果的进展。
1.抗逆转录病毒药物治疗
1996年,华裔科学家何大一提出了抗逆转录病毒联合疗法,俗称“鸡尾酒疗法”。这一里程碑式的治疗方案使用两种以上的抗逆转录病毒组合,展现出了强大的抑制艾滋病毒作用。
针对艾滋病的抗逆转录病毒药物主要分为6大类,分别为[5]:
世界卫生组织在最新的指南中,推荐以多替拉韦(属于整合酶链转移抑制剂)联合一种核苷类逆转录酶抑制剂(NRTI)作为一线治疗方案[4]。
我国推荐2种核苷类逆转录酶抑制剂(NRTI)药物联合第三类药物治疗。第三类药物可以是非核苷类逆转录酶抑制剂(NNRTI)或是增强型蛋白酶抑制剂(PI)[5]。

2.干细胞移植等基因“策略”
前面提到的CCR5基因,其实就对应着艾滋病毒进入细胞时需要结合的一种蛋白质(CCR5蛋白)。
如果人为地让这个基因出现“突变”,使CCR5蛋白无法与艾滋病毒结合,后者便无法在体内传播[6]。通过干细胞(未分化的生物细胞,可以分化为特定细胞)移植,可以将这些携带特定基因的蛋白引入艾滋病病人体内。
近年来,第三代基因编辑技术(CRISPR/Cas)正广泛应用于包括艾滋病治疗在内的精准医疗领域。将CCR5受体从血液干细胞中“敲除”,可以产生没有CCR5基因的分化血细胞[7]。再通过骨髓移植将这些编辑过的血细胞引入体内。
通过上述方式生成的新的免疫系统,或许能够与艾滋病毒“一较高下”。
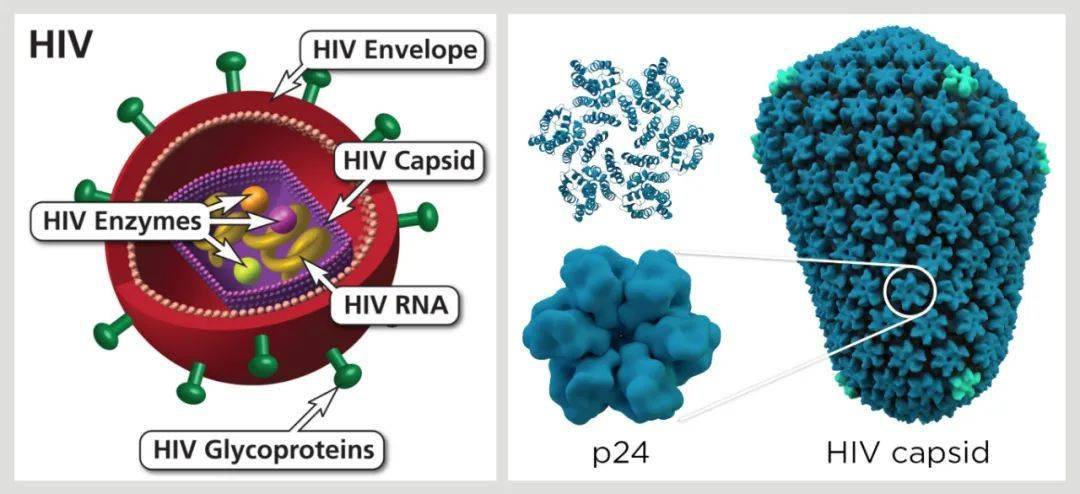

不过,无论是干细胞移植,还是基因编辑技术,目前都还面临着诸多技术挑战和伦理风险。它们的安全性和有效性也还需进一步证实。
尽管目前艾滋病仍无法完全治愈,但层出不穷的新治疗方案,或许能让我们离“治愈艾滋病”的目标越来越近。
此外艾滋病治愈,艾滋病毒感染已成为一种可管理的慢性健康疾病。在找到治愈方法或药物之前,我们也需要谨记艾滋病防治的重点:早检测、早发现、早诊断、早治疗。通过长期、规范的治疗和随访,艾滋病毒感染者完全能够过上正常的生活。
或许,幸运的第“N”人就在不远的未来。
审核专家:李侗曾首都医科大学附属北京佑安医院感染综合科主任医师
参考文献
[1]
[2]世界卫生组织,艾滋病毒实况报道,
[3]Finzi D, Hermankova M, Pierson T, et al. Identification of a reservoir for HIV-1 in patients on highly active antiretroviral therapy[J]. Science, 1997, 278(5341): 1295-1300.
[4]World Health Organization. Consolidated guidelines on HIV prevention, testing, treatment, service delivery and monitoring: recommendations for a public health approach[M]. World Health Organization, 2021.
[5]中国艾滋病诊疗指南(2021年版)
[6]Hütter G, Nowak D, Mossner M, et al. Long-term control of HIV by CCR5 Delta32/Delta32 stem-cell transplantation[J]. New England Journal of Medicine, 2009, 360(7): 692-698.
[7]Ebina H, Misawa N, Kanemura Y, et al. Harnessing the CRISPR/Cas9 system to disrupt latent HIV-1 provirus. Sci Rep 3: 2510[J]. 2013.
*腾讯医典内容团队出品



