封面新闻记者 谭羽清
艾滋病是一种危害性极大的传染病,由感染艾滋病病毒(HIV)引起,这种病毒会攻击人体免疫系统中最重要的CD4+T淋巴细胞,使人体丧失免疫功能,易于感染各种疾病,并发生恶性肿瘤,病死率较高。
目前,在全世界范围内仍缺乏根治HIV感染的有效药物。但十几年来,从2008年的“柏林患者”、2019年的“伦敦患者”再到今年二月公布的“杜塞尔多夫患者”,通过移植造血干细胞“治愈”艾滋病的多个案例似乎又在不断让人看到攻克这种“绝症”的点点希望。
为什么移植造血干细胞能“治愈”艾滋病?此类疗法在未来有望被普及吗?日前,干细胞与再生医学领域学者、中国医学科学院血液学研究所教授、细胞生态海河实验室领军科学家张孝兵教授接受了封面新闻专访。
变异造血干细胞“堵上了HIV的入侵门户”
想要理解造血干细胞移植“治愈”艾滋病的原理,首先得知道HIV是如何在人体内“为非作歹”的。
开头提到,HIV会攻击免疫系统中最重要的CD4+T淋巴细胞,并大量破坏该细胞。而它的攻击方式就是将遗传物质注入CD4+T淋巴细胞中不断复制、增殖,同时杀死淋巴细胞。
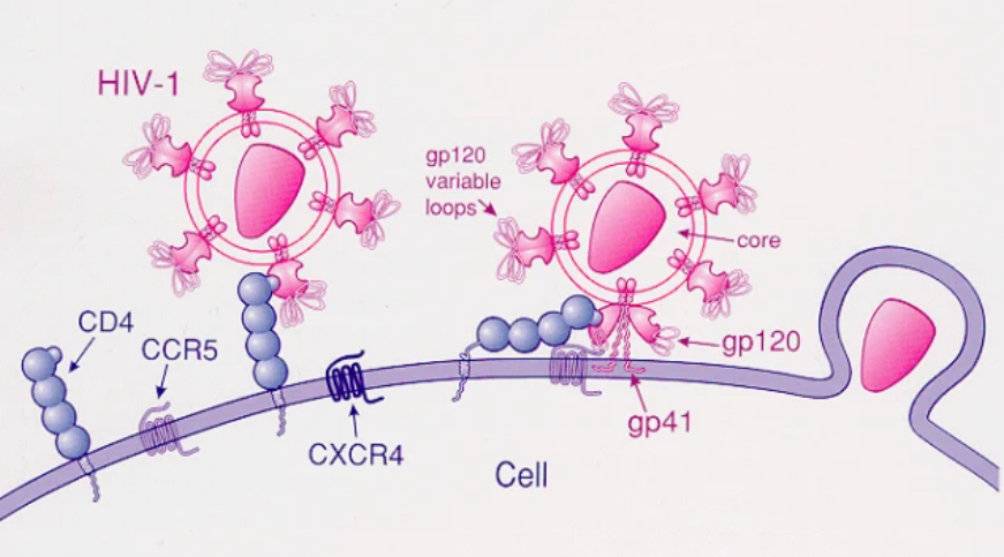
HIV入侵CD4+T淋巴细胞示意图(图片源自网络)
在这场入侵中, CCR5、CXCR4两种蛋白就像是HIV攻入淋巴细胞的“关键门户”,如果没有这两种蛋白其一的帮助,HIV很难成功入侵免疫细胞。
通过移植造血干细胞“治愈”艾滋病正是利用了这点。据相关报道,3名艾滋病病人都是在接受了发生CCR5Δ32/Δ32突变的异体造血干细胞移植后获得“治愈”。
采访中张孝兵告诉记者:“这种CCR5Δ32突变,可以使得造血干细胞分化成的CD4+T淋巴细胞表面缺失CCR5受体或者功能失调,从而阻止病毒利用CCR5受体侵入宿主细胞。”
不过他也提到,因为可被HIV病毒利用的“门户”除了CCR5蛋白还有CXCR4蛋白,如果是利用后者入侵细胞的HIV毒株,或是能同时“走两条道”的HIV毒株,它们仍然有可能通过CXCR4进入细胞。所以,CCR5Δ32/Δ32突变的异体造血干细胞移植仅限“治愈”某些类型的HIV感染。
移植异体CCR5Δ32/Δ32突变造血干细胞可不是件容易事
看上去,移植发生CCR5Δ32/Δ32突变的造血干细胞以对付某些HIV从源头解决了问题,是一个“一劳永逸”的方案,但其实想要让它成为大多数HIV感染者的常规疗法还极具挑战性。
一方面,移植这种变异的造血干细胞对于HIV感染者来说就像一场豪赌。为了让新“入住”的造血干细胞能在患者体内好好发生作用,在移植前,患者需要把体内所有白细胞都杀死,这段时间人体几乎没有免疫力,如果此时病人的CD4+T淋巴细胞本身数量就很低,身体的各项机能都很差,就非常容易发生感染,严重时还可能危及生命。
而在异体造血干细胞移植后,人体还可能不接纳这些新伙伴,产生排异反应和并发症艾滋病治愈,其中约10%接受了异体移植的患者可能会因此丧生。
此外,CCR5功能缺失后的免疫细胞还可能更容易被其他病毒感染。张孝兵提到,虽然目前没有发现被移植者有明显免疫力下降的情况,但不能排除这个可能,所以人为敲除CCR5基因这一行为在学术界还存在很多争议艾滋病治愈,“从自然进化的角度讲,为什么我们要进化出CCR5这个基因,它一定是有道理的。”
另一方面,获取和HIV感染者匹配的CCR5Δ32/Δ32异体造血干细胞也很难。有统计表明,大约只有1%的欧洲人口有着CCR5Δ32/Δ32突变(野生型突变),非洲人中为零,亚洲仅少量人口拥有突变,中国鲜有发现。
诱导式多能性干细胞“曲线救国”或为“治愈”艾滋病提供新思路
那么,当下的生物技术可以用患者本身的造血干细胞人工制造、培育含有CCR5Δ32突变的造血干细胞进行移植吗?这样的自体移植发生排异的可能也会小很多。
答案是可以,但效益低。
张孝兵表示,虽然目前在体外编辑其他细胞已经较为容易,但对于造血干细胞来说,却是比较困难的,最高编辑效率也只有10%左右,也就是只有10%的细胞会具有抗HIV功能,“造血干细胞在体外操作的时间很短,目前只有3天左右,如果超过了这个时间,也许编辑效率会提高,但它植入后的功能会下降甚至丧失。”
然而,如果只能实现10%的编辑效率,这些改造后的造血干细胞对HIV感染者的治疗效果将相对有限,并且可能无法持久。考虑到自体造血干细胞改造和移植疗程可能需要花费数百万元,这种情况下,投入与产出之间的关系将难以保持正比。
尽管采用常规方法进行造血干细胞改造和移植的收益相对较低,但张孝兵认为,未来若能采用一种“曲线救国”的策略,结合诱导多能干细胞技术,利用患者的外周血细胞创造出CCR5基因敲除的诱导多能干细胞,然后再利用这些细胞分化出的造血干细胞进行移植,或许能够获得更为理想的治疗效果。
“多能干细胞是目前已知的唯一一种能在体外无限扩增,而功能不受影响的干细胞。我们可以对它们进行基因编辑后选择完美满足要求的单克隆进行扩增,然后再将它分化为造血干细胞进行移植,这样就不会只有10%的细胞具有抗HIV能力了。”
不过,张孝兵表示,这种方式前景很好,但尚存在一些需要攻克的问题,“比如我们怎么把编辑后的多能干细胞分化成具有很好的体内植入功能的造血干细胞,这又是一个难题。”



