2月14日, “治疗用艾滋病核酸注射液(ICVAX)在ART治疗稳定的HIV/AIDS者的安全性、耐受性和免疫原性I期临床试验” 在深圳市第三人民医院/国家感染性疾病临床医学研究中心(以下简称“深圳三院”)感染与免疫科顺利启动。该项目是深圳三院首次作为牵头单位开展的艾滋病功能性治愈的临床试验,医克生物子公司-深圳医克生物医药有限公司将协助该项目的实施。

图片发自160医护App

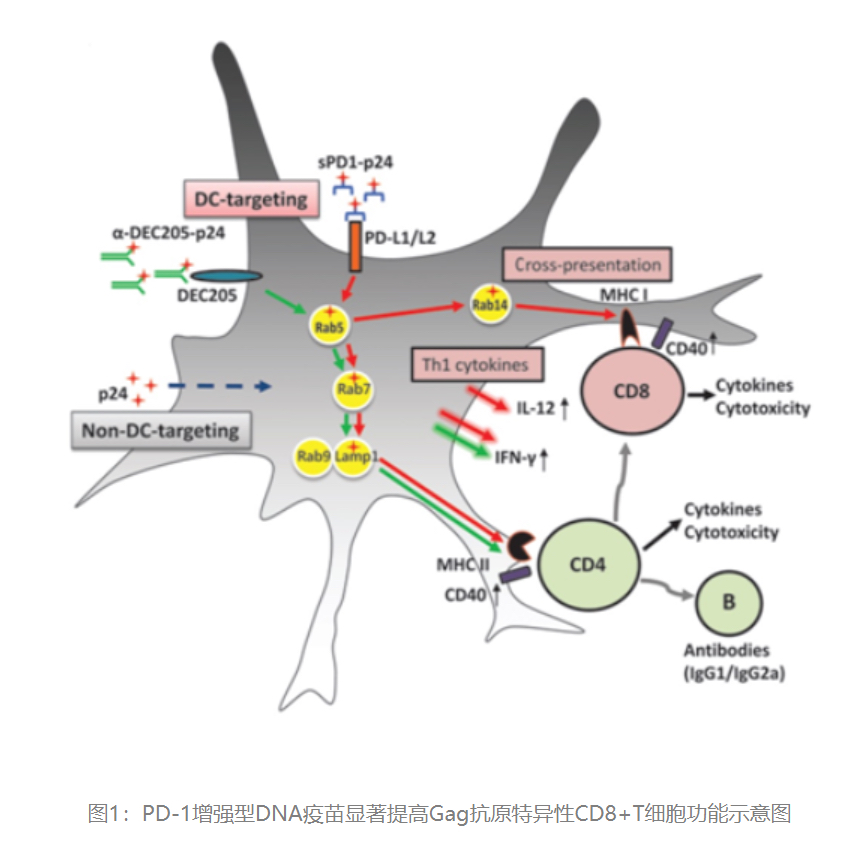
当前,抗病毒治疗可以显著延长HIV感染患者的寿命,但即使最强效的抗病毒治疗组合仍无法根除病毒,至今尚无有效的能推广应用的临床治愈方法。本项目所使用的治疗用艾滋病核酸注射液(ICVAX)的设计源于自有知识产权的创新型核酸疫苗技术平台:PD-1增强型DNA疫苗,该药由香港大学李嘉诚医学院艾滋病研究所陈志伟教授实验室研发,在国家科技部传染病“十二五”、“十三五”重大专项及“深圳市医疗卫生三名工程”等项目的大力支持下,通过与深圳三院王辉教授团队长达十余年的前期合作,顺利完成各项临床前研究,最终于2022年7月获得国家药监局批准进入临床试验,目标为艾滋病的功能性治愈。
该产品的活性成分是一种含有编码人程序性细胞死亡蛋白1(PD-1)片段与二价HIV-1 马赛克Gag p41抗原(Gag p41-1和Gag p41-2)融合蛋白基因的重组质粒DNA。拟定适应证为抗病毒治疗后的补充免疫治疗,通过诱导和增强抗原特异性的细胞免疫反应,促成HIV/AIDS的功能性治愈。目标人群是接受规范的抗病毒治疗的HIV/AIDS患者。该药通过诱导Gag抗原特异性,促使多功能、具有抗病毒活性的效应-记忆CD8+T细胞发挥作用。属于治疗用生物制品1类创新药。该药通过肌肉注射方式给药,并使用电脉冲核酸药物导入仪(EP)作为辅助给药装置,刺激加强药物的原位免疫反应。最终达到增强患者针对HIV病毒细胞免疫记忆和清除病毒的功能。
图片发自160医护App
一、治疗用艾滋病核酸注射液(ICVAX)I期临床试验患者招募要求:
1.HIV-1 感染确证报告阳性;

2.签署知情同意时18-50 周岁,男女均可;
3.已接受 ART 治疗且治疗时间≥12 个月,治疗期间无耐药发生;
4.筛选访视前至少(≥)12 个月血浆 HIV RNA<50copies/ml;
5.近6个月中,CD4+ T细胞计数≥350 cells/μL,且ART开始时CD4+T细胞计数>200 cells/μL
6.肝肾功能及其余各项指标符合研究招募的要求艾滋病治愈,能够理解并自愿签署知情同意书。
二、咨询方式

咨询医生:彭巧丽医生
咨询时间:周一至周五14:00-17:00
咨询地点:深圳市第三人民医院D栋一楼爱心门诊艾滋病治愈,广东省深圳市龙岗区布吉布澜路29号



