近日,发表在《Immunity》的一篇研究中,由Scripps研究所和非盈利疫苗研究组织IAVI的科学家们开发的实验性HIV疫苗已到达了一个重要的里程碑:
该疫苗诱导的抗体可以中和多种HIV毒株。

这项新研究向开发有效的HIV疫苗又迈进了一步。
自1983年发现艾滋病病毒以来,这是医学界的一个主要目标。
利用兔子模型进行的试验表明,这些广泛中和抗体(简称bNAb)至少靶向病毒上的两个关键位点。
研究人员普遍认为,如果要对这种针对不断变化的病毒提供强力保护,就必须诱导bNAb进入艾滋病毒的多个位点。
该研究通讯作者、Scripps研究所免疫学与微生物学系教授Richard Wyatt博士说:“这是原理性的初步证明,但它很重要,我们现在正在努力优化这种疫苗设计。”
图片来源:《Immunity》
根据联合国艾滋病联合规划署(UNAIDS)的数据,全球约有3500万人死于由HIV感染引起的免疫缺陷综合症AIDS(艾滋病)。
现在,约有3800万人感染HIV病毒。
抗病毒药物可以帮助HIV感染者维持生命,并降低其将病毒传播给他人的能力,但是这些药物不能清除感染,因此必须无限期服用。
长期以来,研究人员已经意识到需要一种预防性疫苗,以低成本向未感染者提供,从而消除HIV病毒对公共卫生的重大威胁。
由于HIV的快速突变率和逃避免疫攻击的机制,使其成为疫苗设计人员极难靶向的目标。
但Wyatt及其团队进行的测试证实,疫苗接种可以诱发产生多种抗体,这正是针对HIV病毒提供广泛防护所必需的。
正如疫苗专家所说,这些bNAb可以中和多种HIV病毒株,因为它们与病毒上的关键位点结合,而这些位点在不同毒株之间的差异不大。
感染HIV的患者有时会产生bNAb作为其抗体反应的一部分,但这种情况很少见,而且通常是在已经感染很长时间后才出现的。
HIV病毒疫苗设计者面临的主要挑战是找到刺激免疫系统(大多数或所有个体)的方法,产生能够攻击病毒多个脆弱位点的bNAb,从而抵御大部分的HIV毒株。
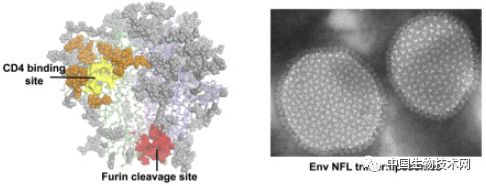
Wyatt及其同事设计的疫苗核心是一种基于HIV的包膜蛋白Env。
通常,灌木状Env的多个副本散布在每个球形HIV颗粒的表面。
每个Env都具有一种可使其与免疫细胞上的CD4受体结合的分子机制,并利用该受体作为进入细胞的入口。
研究人员设计了一个版本的Env,可以模拟真实Env的基本结构,同时足够稳定可以被用作疫苗。
为了以类似真实HIV病毒颗粒的方式来呈现它,他们构建了病毒大小的脂肪分子合成体,即“脂质体”,这些脂质体中密布着研究人员设计的Env蛋白。
图片来源:《Immunity》
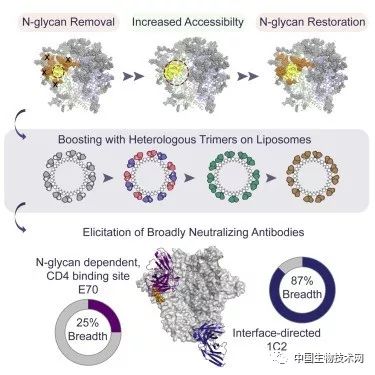
在一个天然的HIV Env蛋白上,被称为聚糖的糖分子通常帮助保护所有重要的CD4结合位点免受免疫攻击。
作为最初的“启动”免疫手段,研究人员使用的Env是其CD4结合位点周围的聚糖屏蔽已被部分去除的。
Wyatt说:“我们的想法是更好地暴露该位点,从而在一开始就刺激针对它的广泛抗体反应。”
在随后48周的加强免疫中,研究人员使用恢复了聚糖屏蔽的Env,以筛选那些穿透聚糖屏蔽依然能靶向CD4结合位点的抗体。
加强免疫注射中的Env蛋白也基于不同的HIV病毒株进行混合,以促进对具有这些Env结构HIV病毒株的抗体反应。
研究团队按照他们的疫苗策略接种了12只兔子,并将结果与只接受单一多糖屏蔽的Env的对照组进行了比较。
他们发现新的疫苗策略有更好的反应,其中五只兔子产生的抗体可以中和多种HIV病毒分离物。
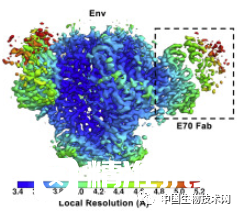
研究人员分析了其中反应最强烈兔子的抗体,并识别出两种不同类型的bNAb。
其中一种被他们称为E70的抗体以一种不同寻常的方式阻断了CD4结合位点,部分方式是通过抓住其中一个聚糖屏蔽。
图片来源:《Immunity》
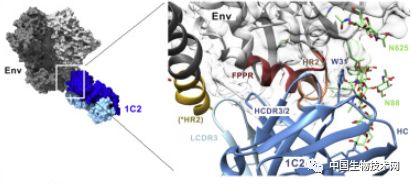
另一个抗体被称为1C2,它攻击Env上一个不同但已知的脆弱点,即在复合蛋白的两个关键片段之间。
1C2的结合显然破坏了Env的稳定性,使其不能再介导HIV进入宿主细胞。
事实证明,该抗体具有非同寻常的中和范围,可以阻断208种不同HIV分离株中的87%。
图片来源:《Immunity》
Wyatt说,这一发现是一个重要的证明,如果以正确的方式接种HIV病毒疫苗,可以实现将bNAb诱导到病毒上多个位点的目标。
该研究团队将继续在小型动物模型中测试和改进其疫苗策略,并希望最终在猴子和人体中对其进行测试。



