撰文/张田勘(专栏作者)
编辑/吉菁菁新媒体编辑/房永珍
造血干细胞移植来治愈艾滋病,近日得到可重复性验证,相关结果发表在顶级医学期刊《柳叶刀·艾滋病病毒》上。
当地时间3月10日,顶级医学期刊《柳叶刀·艾滋病病毒》在线发表了英国剑桥大学医学系教授古普塔(Ravindra Kumar Gupta)等人的最新成果。他们将一年前发表于《自然》(Nature)的一名HIV-1患者在造血干细胞移植后的病情评估从“长期缓解(remission)”改为“治愈(cure)”。

▲在这项最新研究中,作者对患者病情改善的评估从‘长期缓解’改为了‘治愈。(图片来源:Lancet HIV)
从缓解到治愈,是一个艰难的过程,但是,这个过程得到了证明。而且,更有意义的是,这次被称为“伦敦病人”的艾滋病治愈是对之前的“柏林病人”治愈的相互证明,意味着造血干细胞移植治愈艾滋病得到可重复性验证,尽管只有2例。
1995年,在德国柏林工作的美国人蒂莫西·布朗(Timothy Ray Brown)被确诊为艾滋病。2006年,他又被诊断患了急性髓性细胞性白血病(AML)。因此,布朗面临艾滋病和癌症的双重打击,并且难以治疗。在经历一次化疗但癌症还是复发后,主治医生修特(Gero Huetter)向布朗建议用用骨髓移植来治疗白血病。
这个疗法产生了意想不到的一箭双雕的结果。因为,向布朗捐赠骨髓的人具有天生的CCR5基因变异(CCR5-Δ32)。接受骨髓移植后,布朗的白血病不仅治愈,而且体内也检测不到艾滋病病毒(HIV)。在2007年后的10年内,布朗多次检测,都没有查出HIV,直到2017年最后一次验血未查出HIV艾滋病治愈,医生才正式确认布朗是世界上第一位治愈的艾滋病病人。

▲“伦敦病人”出现和治愈,让之前的“柏林病人”Timothy Ray Brown不再只是一个孤例。(图片来源:juliaocoelho.com)
这也意味着,移植带有CCR5-Δ32变异基因的骨髓干细胞(造血干细胞)可以治愈艾滋病。这种方式如今在伦敦病人身上得到重复验证。这名患者现年40岁,是一位英国男性公民,于2003年被诊断出患有艾滋病,9年后又被诊断患有霍奇金淋巴瘤(HL)。
2016年5月伦敦病人接受了造血干细胞移植治疗,供者的造血干细胞携带两个突变CCR5Δ32等位基因。在移植造血干细胞后继续接受抗HIV的药物治疗16个月后,临床小组和患者决定中断抗HIV的药物治疗,以检测患者的真实治疗水平。
结果表明,停用抗HIV的药物后,患者的病毒载量未检测到,患者病情已缓解18个月(移植后35个月)。而且,患者的白细胞没有被HIV感染,说明移植的供体造血干细胞已经转化为患者自己的白细胞。因此艾滋病治愈,医生认定伦敦病人接受造血干细胞移植后,艾滋病处于缓解状态。
现在,对伦敦病人停止抗HIV药物治疗后第28个月,对其血液检测只检测到HIV-1 DNA的极低水平阳性信号。在21个月时,精液中未检测到HIV;22个月时,直肠、盲肠、乙状结肠和末端回肠组织标本均未检测到HIV;25个月时,脑脊液各项指标正常;27个月时,腋窝淋巴结组织中检测出少量HIV膜糖蛋白基因(env)和结构蛋白基因(gag),但没有检测到的DNA整合酶,证明HIV基因组含量低且不完整。
这些情况表明,即便伦敦病人体内还有少量的HIV基因,也不足以导致HIV复发,因此宣布伦敦病人是全球第二位治愈的艾滋病病人。
造血干细胞治愈艾滋病的原理在于,HIV入侵人体免疫T细胞(CD4T细胞)需要依靠T细胞上的分子标记,有几种,一是CD4,二是CCR5,还有少数HIV入侵T细胞需要的第二种分子标记是CXCR4而非CCR5。
但是,如果有人CCR5蛋白的基因出现变异,成为CCR5-Δ32,HIV就无法辨认,因而难以入侵T细胞。
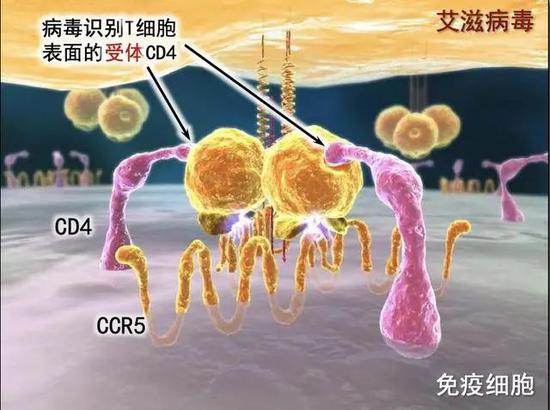
▲CCR5此前曾被现北京大学邓宏魁教授证明是HIV侵入T细胞的主要受体,有1%的欧洲人天生携带CCR5-Δ32的突变。新研究发现,这种突变让这类人群先天对CCR5(R5)嗜性HIV免疫。(图片来源:“数字北京科学中心”微信公众号)
目前大约1%的白人有CCR5-Δ32突变基因,因此天生对艾滋病免疫。移植他们的造血干细胞,并让这种干细胞成为受者体内占多数的T细胞,就可以治愈艾滋病。现在,这名伦敦病人已经有30个月的缓解期,并且在血液、脑脊液、肠道组织或淋巴组织中没有检测到可复制的HIV,而且供体嵌合在外周血T细胞中维持在99%,证明已治愈。在供体嵌合占80%的情况下,终身缓解(治愈)的概率为98%,在供体嵌合占90%的情况下,终身缓解的概率大于99%。
所谓供体嵌合是指,异基因造血干细胞移植后,患者的造血细胞被供体来源的造血细胞取代,而体内的其他组织细胞仍为受者型,称为供体型造血嵌合状态。供体来源血细胞的比例即为供体型嵌合率。一般供体型血细胞比率大于95%,可认为是完全嵌合。
现在,柏林病人和伦敦病人证明移植CCR5-Δ32突变基因的造血干细胞是治愈艾滋病的一个有效途径,为人类征服艾滋病带来曙光。
不过,能接受这一疗法的门槛实际上很高。首先是需要人类白细胞表面抗原(HLA)配型,而且供者有天生的CCR5-Δ32突变基因。仅满足这两点就很不容易。修特医生是在为柏林病人检测了60名捐献者后,才找到HLA配型符合,又带有CCR5-Δ32突变基因的供者。
另外,对于一般的HIV感染者和患者,最大的障碍在于治疗费用,造血干细胞移植一般需要数十万美元,而且有一定风险,死亡率达15%-20%。因此对多数艾滋病患者而言,药物治疗比骨髓移植更简单,安全性更好,而且经济成本一般人都能承受。唯一欠缺的是,药物治疗目前还不能治愈艾滋病。
因此,对于艾滋病,未来药物治疗还是主要的方式,骨髓移植治疗艾滋病当然可以作为各方面条件都具备的患者的一种选择。



