锁住HIV入侵淋巴细胞的大门
研究人员介绍,这名女性患者与上述两位艾滋病治愈者有着截然不同的经历,她在接受脐带血干细胞移植手术后的第17天就出院,并且未出现严重的感染现象。在此次研究中,移植方法相较以往有重大创新,在副作用和配型难这两方面解决了一定问题。
工作人员采用了成体干细胞和脐带血干细胞联合移植的方式:前者来自患者的成年亲属,用于快速恢复机体的血细胞群以减少感染并发症,后者来自无关的新生儿脐带血,携带抗HIV突变,负责长期的血液再造,和骨髓移植相比,脐带血干细胞适应性更强,排异反应等并发症的发生率相对较少。
患者先接受脐带血移植,进入体内的脐带血干细胞相当于一个强大的新生免疫系统。一天后再进行成体干细胞移植,它们繁殖迅速,但会随着时间推移而被脐带血细胞完全取代。
相比于成体干细胞,脐带血的适应性更强,无须与受体有高度HLA(人类白细胞抗原,HLA的匹配与否决定了移植后的免疫排斥反应程度)匹配即可用于移植,也更不容易引起并发症。因此在理论上,这种新方法的治疗群体更广泛,也对患者更加安全友好。
那么为什么必须是CCR5Δ32/Δ32突变的造血干细胞呢?这要从艾滋病病因说起。杜凌遥解释,HIV主要的攻击对象是人体免疫系统中最重要的CD4+T淋巴细胞。HIV会在CD4+T淋巴细胞中不断复制、增殖,同时还会杀死淋巴细胞,导致CD4+T淋巴细胞大量减少,人体就会丧失免疫功能,从而引起严重的机会性感染或是恶性肿瘤,最终导致死亡。
HIV之所以能长驱直入进入CD4+T淋巴细胞,是因为在CD4+T淋巴细胞表面有CCR5蛋白。它和CD4一起就像两把锁,被病毒同时扭动时就为HIV打开了一扇入侵的“大门”。“如果其中一把锁的锁孔消失了,这扇‘门’就打不开,所以当发生CCR5Δ32/Δ32这一基因突变时,病毒入侵CD4+T淋巴细胞的‘大门’就被锁死了,HIV也被阻挡在‘大门’外,使其不能再破坏CD4+T淋巴细胞。”杜凌遥说。
对艾滋病患者实施造血干细胞移植疗法,需要先让患者接受超大剂量放疗或化疗破坏原有的免疫系统,杀死大量已感染HIV的免疫细胞,然后再通过回输CCR5Δ32/Δ32突变的造血干细胞,重建正常造血和免疫功能。
“这种做法相当于摧毁了HIV存在的‘房间’,使之没有生存的土壤。对于HIV的漏网之鱼,也会因为回输干细胞分化而来的CD4+T淋巴细胞锁住了‘大门’,而无法进入新‘房间’。但是在清除血液中HIV的过程中,病人会面临巨大的感染风险,从移植新的造血干细胞到重建机体造血系统,这中间存在一个空档期,在此期间人体是几乎没有免疫力的;同时也存在移植失败的风险,这些都是此方法面临的巨大风险。”杜凌遥强调。
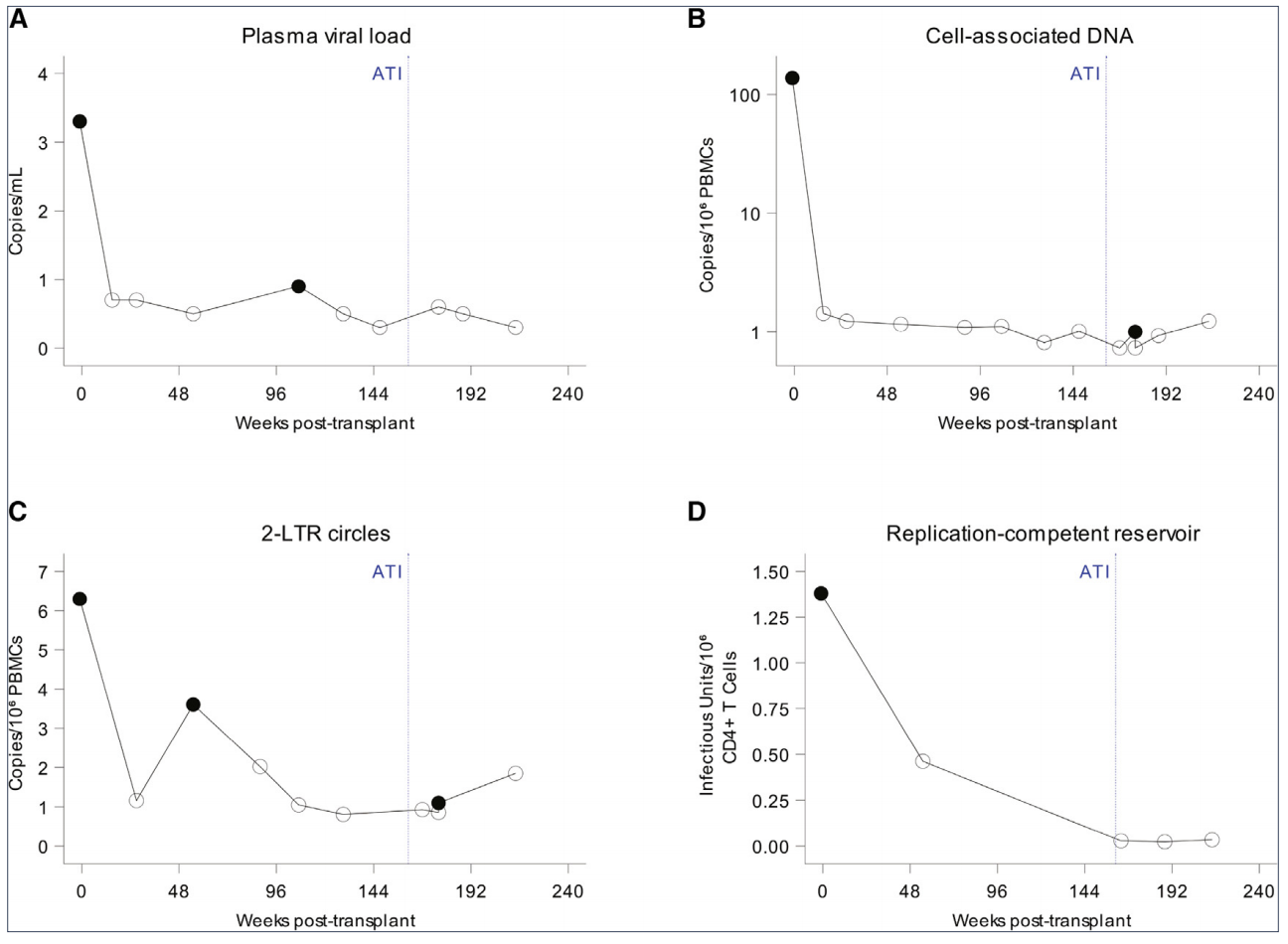
HIV-1持续性的生物标志物在移植前后的变化。图片来源:《细胞》
能作为艾滋病常规疗法吗
在杜凌遥看来,造血干细胞移植疗法要成为艾滋病常规疗法,还需要走较长的路。首先这位女性之所以接受造血干细胞移植手术,是因为她同时患有白血病和艾滋病,“柏林病人”也同时患有白血病和艾滋病,“伦敦患者”则是同时患有霍奇金淋巴瘤和艾滋病。“所以是血液系统疾病需要通过造血干细胞移植来医治,而不是把治疗艾滋病当成造血干细胞移植的主要目的。”
“更何况就像我刚才说的,在移植前要进行预处理,把体内所有白细胞都杀死,此时人体的免疫功能几乎为零。如果HIV感染者身体的各项机能都很差,那么此时非常容易发生感染。即使住进了百级层流无菌病房,由于人肠道等器官也存在细菌艾滋病治愈,因此一旦发生严重感染,有可能危及生命。即使不出现严重感染,还需要过排异关。造血干细胞移植后排异反应和并发症的发生率较高,存在一定的危险性。”杜凌遥表示。
此外,也是非常重要的一点,用来进行移植的造血干细胞要具有CCR5Δ32/Δ32突变。有统计表明,大约只有1%的欧洲人口有着CCR5Δ32/Δ32突变(野生型突变),非洲人中为零,亚洲仅少量人口拥有突变,中国鲜有发现。
当然,我们可以通过人为干预艾滋病治愈,比如基因编辑来帮助CCR5Δ32/Δ32发生突变。但这就涉及到医学伦理和安全性的问题。“我们只看到了它对治疗艾滋病毒的作用,但没看到它在人体身上可能产生的其他影响。陡然给人类基因库带来一个新的突变或者改变突变基因的丰度,后续这部分人患淋巴肿瘤的风险是否会增加?患其他疾病的风险是否会增加?这都是无法预知的,就好像打开了潘多拉魔盒。”杜凌遥说道。
他认为:“如果未来移植手术能变成像输液打针一样安全常规的医疗操作,造血干细胞移植治疗可能会变成治疗艾滋病的常规手段,但就目前的科技和医疗发展水平来看,移植本身就是一项高风险操作,需要非常慎重。”



