由邵一鸣领衔的中国疾病预防控制中心、北京大学和国际学者合作团队近日在国际知名期刊《nature communications》发表最新研究成果:CTL-mediated immunotherapy can suppress SHIV rebound in ART-free macaques。该研究首次通过抗病毒与免疫联合治疗的恒河猴模型,证明疫苗诱导的CTL 过继性免疫治疗,可以控制抗病毒治疗停药后的病毒反弹,为艾滋病功能性治愈研究提供了新策略。

艾滋病是一种危害性极大的传染病,由感染艾滋病病毒(HIV)引起。HIV是一种能攻击人体免疫系统的病毒。它把人体免疫系统中最重要的CD4+T淋巴细胞作为主要攻击目标,大量破坏该细胞,使人体细胞免疫功能缺陷,因此艾滋病治愈,人体易于感染各种疾病,并可发生恶性肿瘤,病死率较高。HIV在人体内的潜伏期平均为8年,也就是说,感染HIV后艾滋病治愈,可以没有任何症状地生活和工作多年。目前,艾滋病已成为严重威胁我国公众健康的重要公共卫生问题。
国际共识认为,实现艾滋病功能性治愈,即将终身治疗转变为阶段性治疗,是当前亟待解决的可持续治疗战略问题。本文研究结果显示在使用HIV疫苗诱导细胞免疫反应峰值时提取并扩增的CD8+T细胞,可降低或完全抑制停药后的病毒反弹,免疫效果显著的动物病毒载量可被抑制于检测水平之下达2 个多月。
他们在进一步的机制研究中发现,免疫抑制的效果与回输细胞中的抗HIV-1 Env基因表位的CTL应答存在剂量依赖关系。病毒反弹被完全控制猴子体内,Env 特异性 CD8+T细胞的多功能反应(p 敲除上述具有良好免疫抑制效果猴子的CD8+T细胞,可使病毒载量迅速反弹到免疫治疗前水平,从而证实是CD8+T细胞介导了病毒的控制。
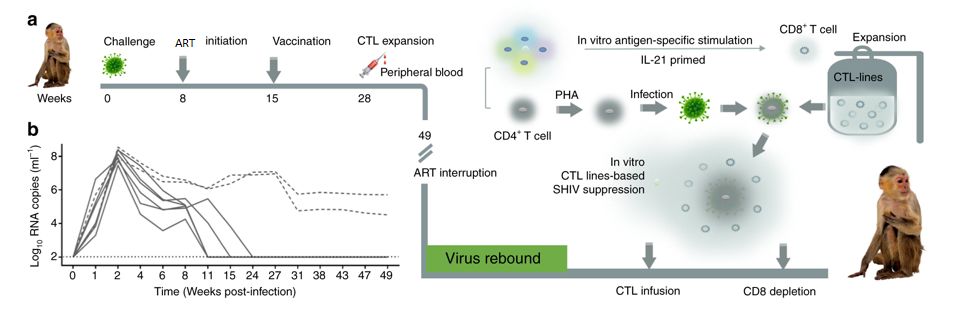
图1 实验设计和主要的干预流程
附文献信息:
DOI:10.1038/s41467-019-09725-6
Abstract:A major barrier to human immunodeficiency virus (HIV) cure is the existence of viral reservoirs that lead to viral rebound following discontinuation of antiretroviral therapy (ART)。 We postulate that enhancing cytotoxic T lymphocytes (CTL) targeting conserved envelope (Env) regions can eliminate HIV infected cells in latency。 Here, we evaluate the use of adoptively transferred HIV vaccine-induced subtype C Env-specific CTLs in a macaque subtype B simian-human immunodeficiency virus (SHIV) model to determine whether plasma viremia can be controlled after ART interruption。
We demonstrate that adoptive cellular therapy (ACT) using autologous Env-specific T cells augmented by therapeutic vaccination can suppress ART-free viral rebound in the SHIV model。 Furthermore, phenotypic and functional characterization of adoptively transferred cells in ACT-responsive and nonresponsive animals support a critical role for cross-reactive central memory T cells in viremia control。 Our study offers an approach to potentiate immunological suppression of HIV in the absence of antiviral drugs。
原文链接:#Fig1





